题目内容
5.(1)小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式:HCO3-+H+=CO2↑+H2O.(2)在海水提溴过程中,吸收塔中用SO2和H2O将Br2转化成氢溴酸以达到富集的目的,请写出化学方程式:SO2+Br2+2H2O=H2SO4+2HBr.
(3)(NH4)2Fe(SO4)2属于盐类,溶于水后会电离出NH4+和Fe2+,写出检验的操作和现象:
a:检验Fe2+:取少量样品于试管中,取少量样品于试管中,加入1~2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,
b:检验NH4+:取适量样品于试管中,取适量样品于试管中,加入浓的氢氧化钠溶液,微热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝色.
分析 (1)小苏打为NaHCO3,胃酸中含盐酸,二者反应生成氯化钠、水、二氧化碳;
(2)溴单质能够将二氧化硫氧化成硫酸,同时生成溴化氢,据此写出反应的化学方程式;
(3)a:Fe2+的检验方法:取少量样品于试管中,加入硫氰酸钾溶液无现象,加入氯水溶液变为血红色或加入NaOH溶液,先产生白色沉淀,然后变成灰绿色最终变成红褐色;
b:NH4+的检验方法:取少量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝.
解答 解:(1)小苏打为NaHCO3,胃酸中含盐酸,用小苏打治疗胃酸过多的离子反应为:H++HCO3-=H2O+CO2↑,
故答案为:HCO3-+H+=CO2↑+H2O;
(2)溴与二氧化硫发生氧化还原反应,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4,
故答案为:Br2+SO2+2H2O=2HBr+H2SO4;
(3)a:Fe2+的检验方法:取少量样品于试管中,加入硫氰酸钾溶液无现象,加入氯水溶液变为Fe3+,硫氰酸钾溶液呈血红色,即Fe3++3SCN-?Fe(SCN)3,
故答案为:取少量样品于试管中,加入1~2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色;
(2)NH4+的检验方法:取少量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝,
故答案为:取适量样品于试管中,加入浓的氢氧化钠溶液,微热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝色蓝.
点评 本题考查了离子方程式、化学方程式的书写、常见离子的检验方法,题目难度中等,注意掌握离子方程式、化学方程式的书写原则,明确亚铁离子、铵根离子的检验方法.

练习册系列答案
相关题目
2.目前工业上获得大量乙烯、丙烯的方法是( )
| A. | 石油分馏 | B. | 石油分馏产品裂解 | ||
| C. | 煤的干馏 | D. | 重油催化裂化 |
16.用NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 82gNa218O2固体与足量的CO2反应转移电子数为NA | |
| B. | 0.1mol Mg在空气中完全燃烧生成氧化镁和二氮化三镁,转移电子数为0.2NA | |
| C. | 标准状况下,11.2L乙醇完全燃烧产生的CO2分子数NA | |
| D. | 1molCnH2n+2中含有的共价键数为(3n+1)NA |
20.取少量某有机物分别进行如下实验,结果是①能使酸性高锰酸钾溶液褪色;②与水混合静置后分层;③加入滴有酚酞试液的强碱,共热后酚酞变无色.此有机物是( )
| A. | 乙酸钠 | B. | 油酸甘油酯 | C. | 乙酸乙酯 | D. | 甲苯 |
10.下列装置用于海水中提取镁,能达到实验目的是( )
| A. |  煅烧石灰石 煅烧石灰石 | B. | 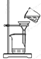 氢氧化镁沉淀过滤 | ||
| C. | 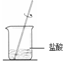 氢氧化镁固体溶解 | D. |  氯化镁晶体制氯化镁 氯化镁晶体制氯化镁 |
17.4月22日是世界地球日,我国今年的地球日主题为:珍惜地球资源,转变发展方式,提高资源利用效益.下列有关做法与此不相符的是( )
| A. | 建立废旧电池回收站,对其进行回收再利用 | |
| B. | 将木材边角料制成木屑颗粒,用作环保能源 | |
| C. | 露天焚烧农作物秸秆还田,用作农作物肥料 | |
| D. | 部分煤炭转直接开采为先在地下气化或液化 |
14.下列反应不属于可逆反应的是( )
| A. | 工业上利用氮气和氢气合成氨气 | |
| B. | 水电解生成氢氧混和气体和氢氧混和气体爆炸生成水 | |
| C. | 密闭容器中的二氧化氮和四氧化二氮在一定压力下可以相互转化 | |
| D. | 密闭容器中的二氧化硫和氧气在一定的条件下可以生成三氧化硫,同时三氧化硫又可以分解为二氧化硫和氧气 |
 已知A、B、C、D、E都是元素周期表中前36号元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与p电子数相等,C在元素周期表的各元素中电负性最大,D原子基态时最外层成对电子对数是单电子数的3倍,E原子基态时未成对电子数是同周期元素中最多的.
已知A、B、C、D、E都是元素周期表中前36号元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与p电子数相等,C在元素周期表的各元素中电负性最大,D原子基态时最外层成对电子对数是单电子数的3倍,E原子基态时未成对电子数是同周期元素中最多的. ,1mol A22-中含有的π键数目为2NA
,1mol A22-中含有的π键数目为2NA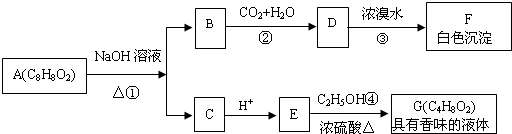
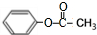 .
.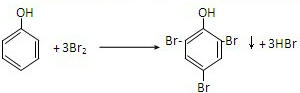 ,该反应的反应类型是取代反应.
,该反应的反应类型是取代反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.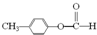 .
.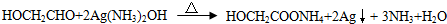 .
.