题目内容
20.(1)在室温时,NaHSO4溶液中c(H+)= c(OH-)+c(SO42-)(填“>”、“=”或“<”),硫酸氢钠溶液与氢氧化钡溶液反应,若溶液中SO42-完全沉淀,则反应后溶液的pH>7(填“>”、“=”或“<”).(2)将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1mol•L-1Na2CO3溶液中,溶液中发生反应的离子方程式为:CO32-+H+═HCO3-;向此反应后的溶液中滴加0.01mol•L-1BaCl2溶液,首先析出的沉淀是BaSO4.[KSP(BaSO4)=1.1×10-10mol2•L-2;KSP(BaCO3)=5.1×10-9mol2•L-2].
分析 (1)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-,溶液中存在电荷守恒,根据电荷守恒判断c(H+)的相对大小c(OH-)+c(SO42-);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,二者反应生成硫酸钡、氢氧化钠和水,则反应后溶液呈碱性;
(2)碳酸根离子和少量的氢离子反应生成碳酸氢根,不放二氧化碳,根据Ksp的含义进行计算.
解答 解:(1)NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-,溶液中存在电荷守恒c(H+)+c(Na+)=c(OH-)+2c(SO42-),物料守恒c(Na+)=c(SO42-),所以得c(H+)=c(OH-)+c(SO42-);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,二者反应生成硫酸钡、氢氧化钠和水,反应方程式为NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,溶液中的溶质是NaOH,则溶液呈碱性,pH>7,
故答案为:=;>;
(2)碳酸根离子和少量的氢离子反应生成碳酸氢根,不放二氧化碳,即CO32-+H+═HCO3-,向此反应后的溶液中滴加0.01mol•L-1BaCl2溶液,根据Ksp的含义:越小,越易生成沉淀,所以首先析出的沉淀BaSO4,
故答案为:CO32-+H+═HCO3-;BaSO4.
点评 本题考查离子浓度大小比较、难溶物的溶解平衡等知识点,侧重考查分析和计算能力,明确溶液中的溶质及其性质是解本题关键,题目难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
14.海波(Na2S2O3•5H2O)可用作脱氯剂、定影剂、解毒剂.硫粉和亚硫酸钠溶液煮沸可得Na2S2O3•5H2O.海波的部分性质如下:易溶于水,不溶于乙醇;熔点48.2℃;在潮湿的空气中易潮解.请回答下列有关实验问题:
(Ⅰ)海波的制取
实验室制备海波过程如下:
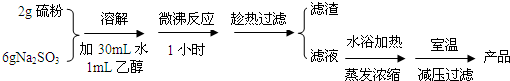
(1)操作中趁热过滤的原因是防止温度降低时海波的析出,以减少海波的损失.
(2)减压过滤后所得初产品需经过洗涤、干燥,洗涤液采用乙醇,而不用蒸馏水或稀硫酸的原因是海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O).

参照丁图简述对海波晶体洗涤的方法关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体.
(Ⅱ)海波纯度的测定
碘水滴定硫代硫酸钠的反应原理为:I2+2S2O32-═2I-+S4O62-.某同学用干燥的锥形瓶称取产品ag,向锥形瓶中加适量的蒸馏水使其溶解,再滴加适量淀粉溶液作为指示剂,然后用c mol•L-1的标准碘水滴定,当达到滴定终点时,消耗VmL标准碘水.
(3)判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色.
(4)该海波(Na2S2O3•5H2O)样品的纯度为$\frac{49.6cV}{a}$%.
(5)下列因素中,导致滴定结果偏高的是BC.
A.锥形瓶未干燥
B.滴定管经水洗后末用标准液润洗
C.滴定前平视,滴定后仰视
D.滴定前,滴定管中的液面处于“0”刻度以下
(Ⅲ)实验探究
探究一:为探究外界条件对化学反应速率的影响因素,取一部分产品与稀硫酸发生反应设计了以下四组实验:
(6)上述四组实验中通过两两比较,能够得出反应速率影响因素的实验组合有4组.
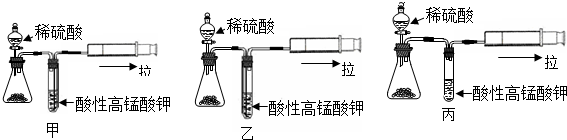
探究二:取一部分初产品与稀硫酸反应,为检验实验过程中产生的SO2气体,设计了如图甲、乙和丙的探究装置.
(7)上述装置中最合理的是乙(填“甲”或“乙”或“丙”),写出检验SO2的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
(Ⅰ)海波的制取
实验室制备海波过程如下:

(1)操作中趁热过滤的原因是防止温度降低时海波的析出,以减少海波的损失.
(2)减压过滤后所得初产品需经过洗涤、干燥,洗涤液采用乙醇,而不用蒸馏水或稀硫酸的原因是海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O).

参照丁图简述对海波晶体洗涤的方法关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体.
(Ⅱ)海波纯度的测定
碘水滴定硫代硫酸钠的反应原理为:I2+2S2O32-═2I-+S4O62-.某同学用干燥的锥形瓶称取产品ag,向锥形瓶中加适量的蒸馏水使其溶解,再滴加适量淀粉溶液作为指示剂,然后用c mol•L-1的标准碘水滴定,当达到滴定终点时,消耗VmL标准碘水.
(3)判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色.
(4)该海波(Na2S2O3•5H2O)样品的纯度为$\frac{49.6cV}{a}$%.
(5)下列因素中,导致滴定结果偏高的是BC.
A.锥形瓶未干燥
B.滴定管经水洗后末用标准液润洗
C.滴定前平视,滴定后仰视
D.滴定前,滴定管中的液面处于“0”刻度以下
(Ⅲ)实验探究
探究一:为探究外界条件对化学反应速率的影响因素,取一部分产品与稀硫酸发生反应设计了以下四组实验:
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

探究二:取一部分初产品与稀硫酸反应,为检验实验过程中产生的SO2气体,设计了如图甲、乙和丙的探究装置.
(7)上述装置中最合理的是乙(填“甲”或“乙”或“丙”),写出检验SO2的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
15.下列说法正确的是( )
| A. | 室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 相同温度下,将足量氯化银固体分别加入:①蒸馏水、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1盐酸、④0.1 mol•L-1硝酸银溶液中,充分溶解后Ag+浓度:①>③=④>② | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
9.下列离子能大量共存的是( )
| A. | PH=1的溶液中:Na+Mg2+CH3COO-SO42- | |
| B. | PH=13的溶液中:Ba2+K+Cl-HCO3- | |
| C. | 无色溶液中:K+Fe3+CO32-NO3- | |
| D. | 透明溶液中:Na+NH4+NO3-MnO4- |
10.下列反应中,气体反应物只做还原剂的是( )
| A. | CO2气体通入石灰水中:CO2+Ca(OH)2═CaCO3↓+H2O | |
| B. | 钠被氧气氧化:4Na+O2═2Na2O | |
| C. | CO气体通过灼热的CuO:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | |
| D. | NH3通入硝酸溶液中:NH3+HNO3═NH4NO3 |
 .
.