题目内容
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 饱和氯水中:NH4+、SO32-、SO42-、Cl- | |
| C. | c(H+)=1.0×10-13mol/L溶液中:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
分析 A.硝酸钾在酸性条件下能够氧化亚铁离子;
B.饱和氯水具有强氧化性,能够氧化;亚硫酸根离子
C.c(H+)=1.0×10-13mol/L溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.与铝反应产生大量氢气的溶液为酸性后强碱性溶液,碳酸根离子与氢离子反应,硝酸根离子在酸性条件下具有强氧化性,与铝反应不会生成氢气.
解答 解:A.KNO3、H+、Fe2+之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.饱和氯水能够氧化SO32-,在溶液中不能大量共存,故B错误;
C.c(H+)=1.0×10-13mol/L溶液为碱性溶液,溶液中存在大量氢氧根离子,K+、Na+、CH3COO-、Br-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.该溶液为酸性或强碱性溶液,CO32-与氢离子反应,NO3-在酸性条件下与铝反应不会生成氢气,在酸性溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
11.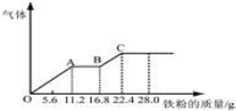 某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )
某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )
 某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )
某稀硫酸和稀硝酸的混合溶液 200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 19.2g(已知硝酸只被还原为 NO 气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示. 下列分析或结果正确的是( )| A. | 每份溶液中NO-3物质的量为 0.4mol | |
| B. | 原溶液中H2SO4浓度为2.5mol•L-1 | |
| C. | 第一份溶液中最终溶质为CuSO4和 Cu(NO3)2 | |
| D. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═Fe2+,BC段产生氢气 |
18.质量都为4.2g的A气体和B气体,在标准状况下的体积分别为3.36L和2.24L,则这两种气体的摩尔质量之比为( )
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 2:3 |
15.若NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 1 molCl2参加反应转移电子数一定为2 NA | |
| B. | 将31g的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1 mol/L | |
| C. | 22.4L的NH3 和16g CH4中所含有的电子数都是10NA | |
| D. | 20g重水(2H216O)含有的电子数为10NA |
16.下列与实验相关的叙述,正确的是( )
| A. | 浓硝酸存放在带橡胶塞的棕色玻璃瓶中 | |
| B. | 四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出 | |
| C. | 向饱和的NaCl溶液中通入足量的NH3后,再通入CO2,有晶体析出 | |
| D. | 某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+ |
