��Ŀ����
����Ŀ��������һ�������Դ������ʹ�����Ϊ�������õĹؼ��������ǵ�ǰ��ѧ����Ҫ��ע���ȵ����⣮
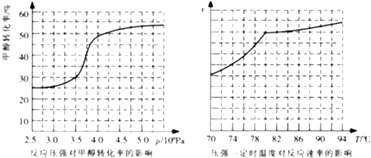
��1���ü�����ȡ������������Ӧ�������仯��ͼ��ʾ�� 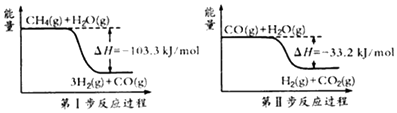
�ټ����ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
�ڵڢ�ӦΪ���淴Ӧ��800��ʱ����CO����ʼŨ��Ϊ2.0molL��1 �� ˮ��������ʼŨ��Ϊ3.0molL��1 �� �ﵽ��ѧƽ��״̬���CO2��Ũ��Ϊ1.2molL��1 �� ��CO��ƽ��ת����Ϊ ��
��2��NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ����NaBO2 �� �ҷ�Ӧǰ��BԪ�صĻ��ϼ۲��䣬�÷�Ӧ�Ļ�ѧ����ʽΪ �� ��Ӧ����1mol NaBH4ʱת�Ƶĵ�����ĿΪ ��
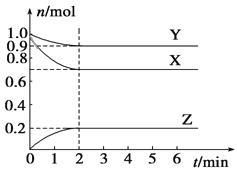
��3������ɽ����л�������û�����ͱ�֮��Ŀ��淴Ӧ��ʵ������ͼ��⣮ 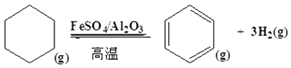
��ij�¶��£�����������м��뻷���飬����ʼŨ��Ϊa molL��1 �� ƽ��ʱ����Ũ��Ϊb molL��1 �� �÷�Ӧ��ƽ�ⳣ��K=���ú�a��b�Ĺ�ϵʽ�����
���𰸡�
��1��CH4��g��+2H2O��g��=4H2��g��+CO2��g����H=��136.5kJ/mol��60%
��2��NaBH4+2H2O=NaBO2+4H2����4NA��2.408��1024
��3��![]() mol3?L��3
mol3?L��3
���������⣺��1���ٸ��ݵ�һ����Ӧ���̿��Եó���CH4��g��+H2O��g��=3H2��g��+CO��g������H=��103.3KJ/mol��
���ݵڶ�����Ӧ���̿��Եó���CO��g��+H2O��g��=H2��g��+CO2��g������H=��33.2KJ/mol��
���ݸ�˹���ɣ�������ʽ��ӿɵã�CH4��g��+2H2O��g��=4H2��g��+CO2��g����H=��136.5 kJ/mol��
���Դ��ǣ�CH4��g��+2H2O��g��=4H2��g��+CO2��g����H=��136.5 kJ/mol��
����CO��ƽ��ת����Ϊx��
CO��g��+ | H2O��g��= | H2��g��+ | CO2��g�� | |
��ʼŨ�ȣ� | 2.0 | 3.0 | 0 | 0 |
�仯Ũ�ȣ� | 1.2 | 1.2 | 1.2 | 1.2 |
ƽ��Ũ�ȣ� | 0.8 | 0.8 | 1.2 | 1.2 |
��CO��ƽ��ת����Ϊ ![]() ��100%=60%��
��100%=60%��
���Դ��ǣ�60%����2��NaBH4��ˮ��Ӧ����NaBO2 �� �ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬NaBO2��BԪ�ػ��ϼ�Ϊ+3�ۣ�����NaBH4��HԪ�صĻ��ϼ�Ϊ��1�ۣ�����HԪ�ػ��ϼ��ɩ�1�ۡ�+1�۱�Ϊ0�ۣ��ٽ��ת�Ƶ����غ���ƽ����ʽΪNaBH4+2H2O=NaBO2+4H2������Ӧ����1mol NaBH4ʱת�Ƶ����ʵ���=1mol��4����1��0��=4mol������ת�Ƶ�����Ϊ4NA��2.408��1024 �� ���Դ��ǣ�NaBH4+2H2O=NaBO2+4H2����4NA��2.408��1024����3�����������ʼŨ��ΪamolL��1 �� ƽ��ʱ����Ũ��ΪbmolL��1 �� ͬһ�����и����ʷ�Ӧ�����ʵ���Ũ��֮�ȵ����������֮�ȣ����Ը��ݷ���ʽ֪���������ƽ��Ũ��Ϊ��a��b��mol/L��������Ũ��Ϊ3bmol/L����ƽ�ⳣ��K= ![]() mol3L��3=
mol3L��3= ![]() =
= ![]() mol3L��3 ��
mol3L��3 ��
���Դ��ǣ� ![]() mol3L��3 ��
mol3L��3 ��
�����㾫�������û�ѧƽ��ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����й��ڴ��������ǿ����ʡ�������ʵ���ȷ�����
������ | ����� | ǿ����� | ������� | �ǵ���� | |
A | ������ | ˮú�� | ���� | ���� | �ɱ� |
B | ������ | �������� | ���ᱵ | ������ | �������� |
C | ���� | ���� | ���Լ� | ������ | ̼��� |
D | ��ˮ | ��ά�� | �Ȼ��� | ������ | ���� |
A.AB.BC.CD.D