题目内容
【题目】根据问题填空:
(1)制造光导纤维的主要原料是(写化学式)
(2)硅是用于制造集成电路、电脑芯片、大阳能电池板(光电池,的半导体材料,硅原子结构示意图 .
(3)实验室不用带玻璃塞的试剂瓶盛放NaOH溶液的原因是:(用化学方程式表示) .
(4)硅酸凝胶经干燥脱水形成硅酸干胶,称为“硅胶”.它具有优良的性,常用于干燥剂,也可作催化剂的载体.
(5)硅酸钠(Na2SiO3)的水溶液俗称 , 常用作黏合剂和木材防火材料.
【答案】
(1)SiO2
(2)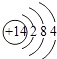
(3)SiO2+2NaOH=Na2SiO3+H2O
(4)吸附
(5)水玻璃(或泡花碱)
【解析】解:(1)二氧化硅具有良好的光学特性,是制备光导纤维主要原料,二氧化硅的化学式为:SiO2;所以答案是:SiO2;(2)硅原子是14号元素,质子数是14,三个电子层,每层电子数分别为2、8、4,所以硅原子结构示意图为 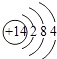 ,所以答案是:
,所以答案是: 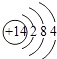 ;(3)玻璃中的二氧化硅与氢氧化钠反应生成具有粘性的硅酸钠溶液,能够将玻璃塞与玻璃瓶粘到一起,反应的方程式:SiO2+2NaOH=Na2SiO3+H2O,所以不能用带玻璃塞的试剂瓶盛放NaOH溶液,
;(3)玻璃中的二氧化硅与氢氧化钠反应生成具有粘性的硅酸钠溶液,能够将玻璃塞与玻璃瓶粘到一起,反应的方程式:SiO2+2NaOH=Na2SiO3+H2O,所以不能用带玻璃塞的试剂瓶盛放NaOH溶液,
所以答案是:SiO2+2NaOH=Na2SiO3+H2O;(4)硅酸凝胶经干燥脱水形成硅酸干胶,称为“硅胶”,硅胶表面积较大,有微孔,它具有优良的吸附性,吸水效果较好,且无毒,所以硅酸凝胶干燥后可作实验室、袋装食品和瓶装药品的干燥剂,硅胶疏松多孔,作干凝胶,可用作催化剂的载体,
所以答案是:吸附;(5)硅酸钠(Na2SiO3)的水溶液俗称“水玻璃”,是建筑行业经常使用的一种黏胶剂,也称为泡花碱,可用作肥皂填料,硅酸钠也可作木材和纺织品的防火剂,
所以答案是:水玻璃(或泡花碱).

 阅读快车系列答案
阅读快车系列答案【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点.
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为 .
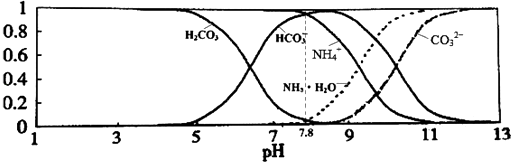
(3)碳酸:H2CO3 , Ki1=4.3×10﹣7 , Ki2=5.6×10﹣11
草酸:H2C2O4 , Ki1=5.9×10﹣2 , Ki2=6.4×10﹣5
0.1mol/LNa2CO3溶液的pH0.1mol/LNa2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是 . 若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 . (选填编号)
a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣] b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣] d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3﹣H2CO3 , 当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象.