题目内容
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL1.0mol/L。
⑴A为 (填“原电池”或“电解池”),其中Ag电极的电极反应式为: ;发生 反应(填“氧化”或“还原”)。
⑵B装置中的电极b极为 极,电极反应式为 ,
总反应的化学方程式为 。
⑶工作一段时间后,当Zn片质量减少6.5g时,a极逸出的气体在标准状况下的体积 L。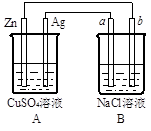
(14分).⑴原电池 (2分)Cu2++2e-="=Cu" (2分)还 原 (2分)
⑵阴 (2分)2H++2e-=H2↑(或2H2O+2e-==H2↑+2OH-)(2分)
2NaCl+2H2O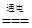 2NaOH+H2↑+Cl2↑ (2分)
2NaOH+H2↑+Cl2↑ (2分)
⑶ 2.24 (2分)
解析试题分析:(1)原电池的构成条件中应有2个活性不同的电极,所以A是原电池;Ag极是正极,发生还原反应,铜离子得电子生成单质铜,电极反应式为Cu2++2e-==Cu;
(2)装置B中b极与锌极相连,所以b是阴极,发生还原反应,氢离子得电子生成氢气,2H++2e-==H2↑(或2H2O+2e-=H2↑+2OH-);总反应是电解饱和食盐水的反应:2NaCl+2H2O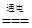 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3)当Zn片质量减少6.5g时,说明导线上有0.2mol电子通过,a极产生氯气,根据得失电子守恒,氯气的物质的量是0.1mol,所以a极逸出的气体在标准状况下的体积2.24L。
考点:考查对电化学装置的判断,电化学理论的应用

如图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: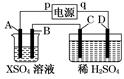
(1)p为 极,A极发生了 反应。
(2)C为 极,可收集到 ;D为 极,可收集到 。
(3)C极的电极反应式为 。
(4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极产生气体 的体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极产生气体 的体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
仔细分析以上实验数据,请说出变化的可能原因是
。
(5)当反应进行一段时间后,A、B电极附近溶液的pH (填“增大”“减小”或“不变”)。
(6)当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为 。
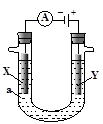

 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。 FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe— XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。