题目内容
(11分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: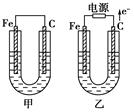
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,该池中溶液体积是200 mL,则溶液混匀后的pH=________。
(1)①碳; 铁; ②4OH--4e-===2H2O+O2↑;(2)①2Cl-+2H2O通电Cl2↑+H2↑+2OH-;
②2H2O+O2+4e-===4OH- 氧化反应;③13。
解析试题分析:由图可知 甲池是原电池,乙池是电解池; (1) ①对于甲池来说,Fe为负极,失去电子,Cu2+在碳棒上得到电子,变为单质Cu附着在上边。所以若两池中均为CuSO4溶液,反应一段时间后碳棒上会有红色的铜单质产生;对于乙池来说,C为阳极,Fe为阴极。所以Cu2+在铁棒上得到电子,变为单质Cu附着在上边。因此反应一段时间后铁棒上会有红色的铜单质产生;②在乙池中OH-的放电能力比SO42-强,所以是OH-在阳极放电。该电极反应式是4OH--4e-===2H2O+O2↑;(2)若两池中均为饱和NaCl溶液,①在乙池中阳离子的放电能力是H+>Na+,所以在阴极上H+放电;阴离子的放电能力是Cl- >OH-,所以是Cl-在阳极上放电。总反应的离子方程式是2Cl-+2H2O通电Cl2↑+H2↑+2OH-;②对于甲池中来说,碳极为正极,由于是中性环境,所以发生的是吸氧腐蚀,在C棒上电极反应式是2H2O+O2+4e-===4OH-;②乙池中碳极是阳极,所以在C棒上发生的反应是氧化反应,反应式是2Cl--2e-= Cl2↑;③若乙池转移0.02 mol e-后停止实验根据反应方程式可知产生OH-的物质的量为0.02 mol,由于V=0.2L,所以c(OH-)=0.1mol/L;根据水的离子积常数可得c(H+)=10-14÷10-1=10-13mol/L所以溶液混匀后的pH=13。
考点:考查原电池、电解池的反应原理及应用的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+ |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+, |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥