题目内容
【题目】到目前为止人们已发现或合成了118种元素,元素①-⑨在周期表中的位置如下表所示(序号代表对应的元素)。
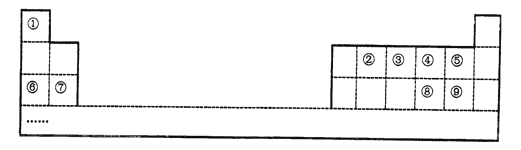
(1)②在周期表中的位置_________
(2)元素⑤、⑧、⑨中,原子半径从大到小的顺序是________(用元素符号表示)
(3)⑥与⑦的最高价氧化物对应的水化物的碱性强弱为______。(填化学式)
(4)①分别与②③④⑤形成的化合物中,最稳定的物质的化学式是______.
(5)能说明⑨的非金属性比③强的化学方程式为_______
(6)化合物甲是元素③形成的最简单氢化物,甲的电子式是___。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是_______。
【答案】 第2周期ⅣA族 S>Cl>F NaOH、Mg(OH)2 HF 2NH3+3Cl2=N2+6HCl或8NH3+3Cl2=N2+6NH4Cl ![]() 3H2O2+2NH3=N2+6H2O或3H2O2+2NH3·H2O=N2+8H2O
3H2O2+2NH3=N2+6H2O或3H2O2+2NH3·H2O=N2+8H2O
【解析】根据元素在周期表中的位置可知①~⑨元素分别是H、C、N、O、F、Na、Mg、S、Cl。
(1)②为碳元素,在周期表中位于第2周期ⅣA族;正确答案:第2周期ⅣA族。
(2)元素⑤为F、元素⑧为S、元素⑨为Cl,同一周期,从左到右,原子半径减小,同一主族,从上到下,原子半径增大,因此原子半径从大到小的顺序是S>Cl>F ;正确答案: S>Cl>F。
(3)元素⑥为Na、元素⑦为Mg,金属性越强,该元素最高价氧化物的水化物碱性就越强,因此二元素的最高价氧化物对应的水化物的碱性NaOH大于Mg(OH)2;正确答案:NaOH、Mg(OH)2。
(4)氢元素分别与C、N、O、F形成的化合物中,元素的非金属性越强,氢化物越稳定,所以四种氢化物中最稳定的为.HF;正确答案: HF。
(5) 元素⑨为Cl,元素③为N,利用氯气的氧化性大于氮气的氧化性进行验证,氯气与氨气反应生成氮气和氯化氢或氯化铵,反应方程式:2NH3+3Cl2=N2+6HCl或8NH3+3Cl2=N2+6NH4Cl;正确答案:2NH3+3Cl2=N2+6HCl或8NH3+3Cl2=N2+6NH4Cl。
(6)③为氮元素,其形成的最简单氢化物为氨气,电子式是![]() ;H2O2与氨气反应生成氮气和水,反应方程式为3H2O2+2NH3=N2+6H2O或3H2O2+2NH3·H2O=N2+8H2O;正确答案:
;H2O2与氨气反应生成氮气和水,反应方程式为3H2O2+2NH3=N2+6H2O或3H2O2+2NH3·H2O=N2+8H2O;正确答案:![]() ;3H2O2+2NH3=N2+6H2O或3H2O2+2NH3·H2O=N2+8H2O。
;3H2O2+2NH3=N2+6H2O或3H2O2+2NH3·H2O=N2+8H2O。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3受热易分解,生成了遇水显碱性的物质 |
D. | 向某溶液中加入盐酸,将生成的气体通入品红溶液中 | 品红溶液褪色 | 该溶液一定含有SO32- |
A. A B. B C. C D. D