题目内容
14.下列物质中含离子键的是( )| A. | HCl | B. | CH4 | C. | NaH | D. | NH3 |
分析 一般来说,活泼金属元素和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,据此分析解答.
解答 解:A.HCl分子中H-Cl原子之间只存在共价键,故A错误;
B.甲烷分子中C-H原子之间只存在共价键,故B错误;
C.NaH中钠离子和氢离子之间只存在离子键,故C正确;
D.氨气分子中N-H原子之间只存在共价键,故D错误;
故选C.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确物质的构成微粒即可解答,注意二者区别.

练习册系列答案
相关题目
4.中和热测定实验中,下列操作一定会降低实验准确性的是( )
| A. | 用滴定管取所用药品 | |
| B. | NaOH溶液在倒入小烧杯时,有少量溅出 | |
| C. | 大小烧杯体积相差较大,夹层间放的碎泡沫塑料较多 | |
| D. | 测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度 |
5.把一小块钠投入到硫酸铜溶液中,下列物质中不是该反应的生成物的是( )
| A. | Cu | B. | Cu(OH)2 | C. | H2 | D. | Na2SO4 |
2.25℃时,下列各溶液中,离子的物质的量浓度关系正确的( )
| A. | 0.1 mol•L-1醋酸溶液中:c(H+)=c(CH3COO- )+c(OH- ) | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | 氯化铵溶液:c(NH+4)>c(Cl-)>c(H+)>c(OH-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
9.常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的量浓度均为0.1mol•L-1,下列说法正确的是( )
| A. | 四种溶液的pH的大小顺序:①>④>③>② | |
| B. | 将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3•H2O) | |
| C. | 向溶液①、②中分别滴加25mL 0.1mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | 将溶液③、④等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
19.能增加反应物分子中活化分子的百分数的是( )
①升高温度
②增加浓度
③增大压强
④使用催化剂.
①升高温度
②增加浓度
③增大压强
④使用催化剂.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ①③④ |
6.下列关于Na2O和Na2O2的叙述正确的是( )
| A. | Na2O与Na2O2颜色相同 | B. | 均可与CO2、H2O反应产生氧气 | ||
| C. | 所含氧元素的化合价均为-2 | D. | 阴阳离子的个数比均为1:2 |
3.两个体积相等的容器,一个盛有CO,另一个盛有N2和O2,在同温同压下两个容器内的气体一定具有相同的( )
| A. | 原子总数 | B. | 质子总数 | C. | 电子总数 | D. | 质量 |
2.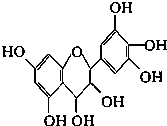 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
 从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )
从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( )| A. | 该物质既可看作醇类,也可看作酚类 | |
| B. | 1mol该物质可与4molBr2反应 | |
| C. | 1mol该物质可与7molNaOH反应 | |
| D. | 1mol该物质可与7molNa反应 |