题目内容
【题目】下列离子方程式书写正确的是![]()
A.金属钠投入水中:![]()
B.往酸性碘化钾溶液中滴加适量的双氧水:![]()
C.往![]() 溶液中加过量的NaOH溶液并加热:
溶液中加过量的NaOH溶液并加热:![]()
![]()
![]()
D.氯气通入水中:![]()
【答案】B
【解析】
A.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒;
B.双氧水将碘离子氧化成碘单质;
C.氢氧化钠足量,碳酸氢根离子也参与反应;
D.次氯酸为弱酸,离子方程式中不能拆开。
![]() 金属钠投入水中生成氢氧化钠和氢气,正确的离子方程式为:
金属钠投入水中生成氢氧化钠和氢气,正确的离子方程式为:![]() ,故A错误;
,故A错误;
B.往酸性碘化钾溶液中滴加适量的双氧水,二者发生氧化还原反应,反应的离子方程式为:![]() ,故B正确;
,故B正确;
C.往![]() 溶液中加过量的NaOH溶液并加热,漏掉了碳酸氢根离子与氢氧根离子的反应,正确的离子方程式为
溶液中加过量的NaOH溶液并加热,漏掉了碳酸氢根离子与氢氧根离子的反应,正确的离子方程式为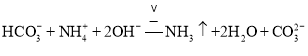 ,故C错误;
,故C错误;
D.氯气通入水中生成氯化氢和次氯酸,次氯酸不能拆开,正确的离子方程式为:![]() ,故D错误;
,故D错误;
故选:B。

【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
(2)从下表中选择,称量NaOH固体所需要的仪器是(填字母)________。
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如图所示。
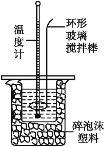
(1)若生成1 mol H2O时反应放出的热量为57.3 kJ,写出该反应的热化学方程式:__________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②用上述实验数值计算结果为____kJmol-1,与57.3 kJmol-1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
时间(s) | 0 | 2 | 4 |
c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
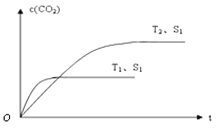
①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
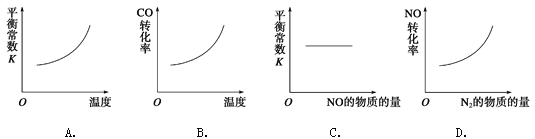
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是