题目内容
FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后仍有固体存在,则下列判断不正确的是
| A.加入KSCN溶液一定不变红色 |
| B.溶液中一定含Fe2+ |
| C.溶液中一定含Cu2+ |
| D.剩余固体中一定含Cu |
C
解析试题分析:根据三价铁离子氧化性强于铜离子的氧化性判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无三价铁离子存在,一定存在亚铁离子,可能含有铜离子;若有铁剩余,一定有铜生成,三价铁离子和铜离子无剩余,据此进行判断。①当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的方程式为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+;②当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+。A、溶液中一定不含Fe3+,所以加入KSCN溶液不变红色,故A说法正确;B、通过以上分析知,溶液中一定含有Fe2+,故B说法正确;C、通过以上分析知,溶液中可能含有Cu2+,故C说法错误;D、通过以上分析知,剩余固体中一定含Cu,故D说法正确,答案选C。
考点:考查氯化铁、氯化铜的混合液与铁反应的判断

将Cu片放入0.1 mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中C(Fe3+):C(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为 ( )
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
下列各组物质相互反应后,再向得到的溶液中滴入KSCN试剂,溶液变成红色的是
| A.氯水和氯化亚铁溶液 | B.铁屑和氯化铜溶液 |
| C.铁屑和过量稀硫酸 | D.过量铁屑和氯化铁溶液 |
为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是( )
| A.合金中镁的质量分数为63.3%≤Mg%<100% |
| B.该合金中含有铝的质量至少为5.4 g |
| C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2 |
| D.在产生沉淀后的溶液中有1.5 mol Na2SO4 |
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
下列说法正确的是
| A.固体混合物中一定含有Al,但质量不可确定 |
| B.固体混合物中可能含有MgCl2和AlCl3 |
| C.固体混合物中一定含有MgCl2和FeCl2 |
| D.固体混合物中一定含有 (NH4)2SO4、MgCl2 |
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是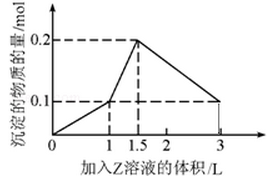
| A.氯化铝、氯化镁、氢氧化钠 |
| B.偏铝酸钠、氢氧化钡、硫酸 |
| C.氯化铝、氯化铁、氢氧化钠 |
| D.偏铝酸钠、氯化钡、硫酸 |
将含1 mol Na和1 mol Al的合金加入足量的水中,下列描述不正确的是 ( )
| A.金属Al无剩余 | B.c(Na+)=c(AlO-2) |
| C.生成气体为2 mol | D.c(Na+)=c(Al3+) |
把生锈的铁钉放入足量稀盐酸中,可能发生的反应是( )
| A.只有置换反应 | B.只有复分解反应 |
| C.置换和复分解反应 | D.置换和分解反应 |