题目内容
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: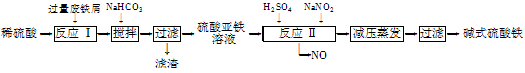
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是 。
(3)反应Ⅱ的离子方程式为 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为 。
A.22.1 g B.27.2 g C.30 g D.无法确定
(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+(2分,答对一点即可得2分,其它合理答案也可)
(2)Al3+(1分)
加快反应速率(或使反应物充分接触)(1分,意思相近均给分)
(3)Fe2+ + NO2- + 2H+ = Fe3+ + NO↑ + H2O (2分,漏反应条件或“↑”扣1分;未配平扣1分);
氧化剂(1分);
2 mol(1分)
(4)2Fe(OH)2++2H2O Fe2(OH)42-+2H+(2分,写成等号扣1分;未配平扣1分)
Fe2(OH)42-+2H+(2分,写成等号扣1分;未配平扣1分)
(5)D(2分,多选0分)
(6)B(3分)
解析试题分析:(1)加入过量的铁可以与硫酸和Fe3+反应,为后面调节pH除去多余的硫酸并将Fe3+尽可能转化为Fe2+,(2)根据流程图得到的是硫酸亚铁溶液,所以先沉淀的是Al3+ ,搅拌可以加快反应速率;(3)Fe2+和NO2-在酸性条件下发生氧化还原反应:Fe2+ + NO2- + 2H+ = Fe3+ + NO↑ + H2O,氧气和亚硝酸钠都做氧化剂,1 mol氧气转移电子4mol ,1 mol亚硝酸钠转移电子1mol,根据电子守恒可得;(4)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+,;(5)酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色;(6)加入氢氧化钠后,金属质量减少的就是铝的质量。根据电子守恒可分别计算出铁和镁的质量,最后计算出沉淀质量。
考点:考查工艺流程、氧化还原反应离子方程式的书写及有关计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(本题共16分)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。为了将Mn2+降到1.0×10-9mol/L,则c(Na2S)至少是 mol/L。
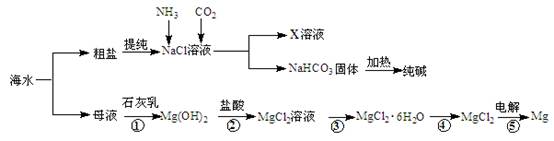
卤块的主要成分是MgCl2,此外还含 Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图: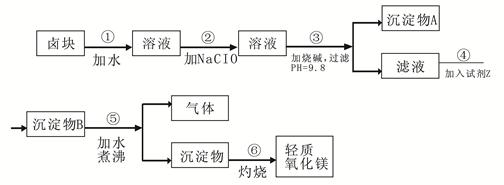
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 化学试剂价格表
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
(1)在步骤②中加入漂液而不是双氧水其原因是 。
写出加入NaClO发生反应的离子方程式 。
(2)在步骤③中控制pH=9.8,其目的是 。
(3)沉淀物A的成分为 ,试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在 (填仪器名称)中灼烧。
高铁酸钾(K2FeO4)是新型多功能水处理剂,碱性条件下性质稳定,其生产过程如下: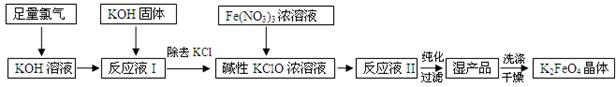
请回答下列问题
(1)氯碱工业制Cl2的化学反应方程式 ;
(2)生成“反应液Ⅱ”的离子方程式是 ;(3)使用碱性KClO的原因是 ;
(4)从“反应液II”中分离出K2FeO4后 ,副产品是KCl和 (填化学式),该混合物可用 方法分离提纯(填字母序号);
| A.过滤 | B.分液 | C.蒸馏 | D.重结晶 |
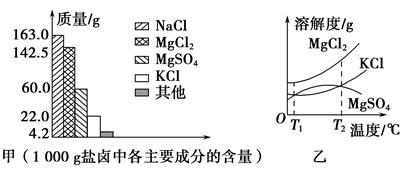
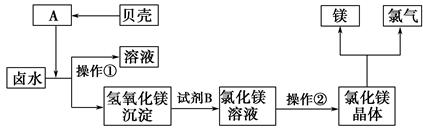
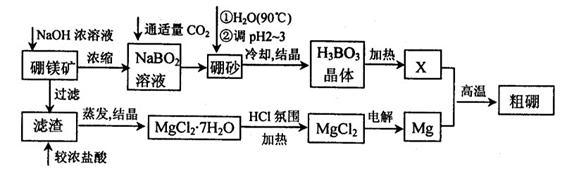
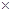 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。