题目内容
14.下列表示对应化学反应的离子方程式正确的是( )| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4++OH-=NH3↑+H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4 NH4++2H2O | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O |
分析 A.反应生成硝酸亚铁;
B.少量NaOH,只发生氢离子与碱的反应;
C.反应生成氢氧化铝和氯化铵;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:稀硝酸和过量的铁屑生成二价的铁,离子反应为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故A错误;
B.硫酸氢铵溶液中加入少量氢氧化钠溶液的离子反应为H++OH-=H2O,故B错误;
C.氢氧化铝不溶于氨水,氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.Na2SO3溶液使酸性KMnO4溶液氧化而褪色,则该氧化还原反应的离子反应为5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
4.下列各组物质可按溶解、过滤、蒸发的操作顺序将它们分离的是( )
| A. | 硝酸钾和硝酸钠 | B. | 硫酸钠和硫酸钡 | C. | 氧化铜和碳粉 | D. | 水和酒精 |
5.亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2═4ClO2↑+H++Cl-+2H2O.分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量的ClO2,这是因为( )
| A. | 酸使亚氯酸的氧化性增强 | |
| B. | 溶液中的H+起催化作用 | |
| C. | 溶液中的Cl-起催化作用 | |
| D. | 逸出的ClO2使反应生成物的浓度降低 |
2.以下化学反应的离子方程式书写正确的是( )
| A. | 碳酸钠溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═Fe2++I2 | |
| C. | 少量氯气通入溴化亚铁溶液中3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| D. | NaHCO3溶液水解:HCO3-+H2O=H2CO3+OH- |
9.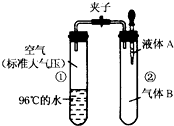 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 水、氨气 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 水、HCl |
19.已知下表所示数据:
某学生实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
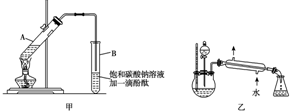
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30mL的大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(3)指出步骤③所观察到的现象:在浅红色碳酸钠溶液液面上有无色油状液体生成,可闻到香昧,振荡后碳酸钠溶液红色变浅,油层变薄.
分离出乙酸乙酯层后,一般用饱和食盐水或饱和氯化钙溶液洗涤,可通过洗涤主要除去碳酸钠、乙醇(填名称)杂质;为了干燥乙酸乙酯可选用的干燥剂为B(填字母).
A.P2O5 B.无水Na2SO4C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图乙所示的制取乙酸乙酯的装置(图中的部分装置略去),与图甲装置相比,图乙装置的主要优点有①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯.
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.

请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30mL的大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(3)指出步骤③所观察到的现象:在浅红色碳酸钠溶液液面上有无色油状液体生成,可闻到香昧,振荡后碳酸钠溶液红色变浅,油层变薄.
分离出乙酸乙酯层后,一般用饱和食盐水或饱和氯化钙溶液洗涤,可通过洗涤主要除去碳酸钠、乙醇(填名称)杂质;为了干燥乙酸乙酯可选用的干燥剂为B(填字母).
A.P2O5 B.无水Na2SO4C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图乙所示的制取乙酸乙酯的装置(图中的部分装置略去),与图甲装置相比,图乙装置的主要优点有①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯.
3.能够用于鉴别SO2和CO2的溶液是( )
| A. | 石蕊试液 | B. | 品红溶液 | C. | 澄清石灰水 | D. | 氯化钡溶液 |
 R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.
R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.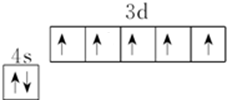 ;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.
;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.