题目内容
2.(1)写出下列物质在水溶液中的电离方程式:①Ba(OH)2:Ba(OH)2=Ba2++2OH-;
②KHSO4:KHSO4=K++H++SO42-;
(2)写出下列物质在水溶液中的离子方程式:
③HNO3与醋酸钠(CH3COONa):H++CH3COO-=CH3COOH;
④Na2CO3与澄清石灰水反应:CO32-+Ca2+=CaCO3↓.
分析 (1)①氢氧化钡为强电解质,完全电离;
②硫酸氢钾为强电解质,完全电离;
(2)①二者反应生成硝酸钠和醋酸;
②二者反应生成碳酸钙和氢氧化钠.
解答 解:(1)①氢氧化钡为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-;
故答案为:Ba(OH)2=Ba2++2OH-;
②硫酸氢钾为强电解质,完全电离,电离方程式:KHSO4=K++H++SO42-;
故答案为:KHSO4=K++H++SO42-;
(2)③HNO3与醋酸钠(CH3COONa),离子方程式:H++CH3COO-=CH3COOH;
故答案为:H++CH3COO-=CH3COOH;
④二者反应生成碳酸钙和氢氧化钠,离子方程式:CO32-+Ca2+=CaCO3↓;
故答案为:CO32-+Ca2+=CaCO3↓.
点评 本题考查了电解质电离方程式、离子方程式的书写,明确电解质强弱、离子反应实质是解题关键,题目难度不大.

练习册系列答案
相关题目
13.为了除去铁粉中的少量铝粉,可以选取下列哪种溶液( )
| A. | 浓盐酸 | B. | 浓氢氧化钠溶液 | C. | 硫酸 | D. | 硝酸 |
17.冬季的降雪给机场和马路带来诸多不便,其中醋酸钾(CH3COOK)是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是( )
| A. | 1 mol CH3COOK的质量为98 g•mol-1 | |
| B. | CH3COOK的摩尔质量等于它的相对分子质量 | |
| C. | 一个CH3COOK微粒的质量约为98 g/NA | |
| D. | 含有6.02×1023个碳原子的CH3COOK的物质的量为1 mol |
7.下列关于药物的使用说法正确的是( )
| A. | 随着药店的普及,药物都可以直接去药店购买,不需要去医院 | |
| B. | 青霉素时一种常用药,感冒发烧、咳嗽肺炎都可以使用 | |
| C. | 长期大量使用阿司匹林可预防疾病,没有副作用 | |
| D. | 虽然药物能治病,但大部份药物有毒副作用 |
11.用下列实验装置或操作进行的实验能达到实验目的是( )
| A. | 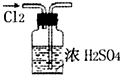 干燥Cl2 干燥Cl2 | B. | 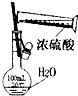 配制100ml 0.1mol•L-1硫酸溶液 | ||
| C. | 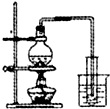 制取少量蒸馏水 | D. |  检验钾元素的存在 |
12.要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们( )
| A. | 溶解、过滤 | |
| B. | 制成热的硝酸钾饱和溶液,降温后再过滤 | |
| C. | 制成溶液后直接蒸干 | |
| D. | 先溶解、再蒸发结晶,趁热过滤 |
 ,正确名称:2,4二甲基己烷
,正确名称:2,4二甲基己烷 ,正确名称:2,2,3,3,4五甲基己烷
,正确名称:2,2,3,3,4五甲基己烷 ,正确名称:2,2,3,3四甲基4乙基庚烷
,正确名称:2,2,3,3四甲基4乙基庚烷 ,正确名称:2,3,4,5四甲基3,5二乙基辛烷.
,正确名称:2,3,4,5四甲基3,5二乙基辛烷.