题目内容
(16分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下 列问题:
列问题:
(1)X的化学式为___ __,D的原子结构示意图为___ __。
(2)元素的非金属性C______ E(填“>”、“<”或“=”)。
下列各项中,能说明这一结论的事实有_____ _(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)BC和BC2气体可用纯碱溶液吸收,有关化学方程式为:
2 BC2+Na2CO3=NaBC2+NaBC3+CO2↑
BC+BC2+Na2CO3=2NaBC2+CO2↑
① 配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
② 现有1000g质量分数为21.2%的纯碱吸收液,吸收BC和BC2混合气体,每产生22.4L(标准状况)CO2时,吸收液质量增加44g。
(a)计算吸收液中NaBC2和NaBC3物质的量之比。
(b)1000g质量分数为21.2%的纯碱吸收液在20℃经充分吸收BC和BC2混合气体后,蒸发掉688g水,冷却到0℃,最多可析出NaBC2多少克?(0℃时,NaBC2的溶解度为71.2g /100g水)
请回答下
 列问题:
列问题:(1)X的化学式为___ __,D的原子结构示意图为___ __。
(2)元素的非金属性C______ E(填“>”、“<”或“=”)。
下列各项中,能说明这一结论的事实有_____ _(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)BC和BC2气体可用纯碱溶液吸收,有关化学方程式为:
2 BC2+Na2CO3=NaBC2+NaBC3+CO2↑
BC+BC2+Na2CO3=2NaBC2+CO2↑
① 配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
② 现有1000g质量分数为21.2%的纯碱吸收液,吸收BC和BC2混合气体,每产生22.4L(标准状况)CO2时,吸收液质量增加44g。
(a)计算吸收液中NaBC2和NaBC3物质的量之比。
(b)1000g质量分数为21.2%的纯碱吸收液在20℃经充分吸收BC和BC2混合气体后,蒸发掉688g水,冷却到0℃,最多可析出NaBC2多少克?(0℃时,NaBC2的溶解度为71.2g /100g水)
(1)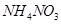
(2)> ②③
(3) ①
②(a)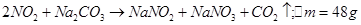
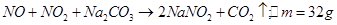
设由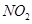 与纯碱反应产生的
与纯碱反应产生的 为amol
为amol
由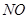 和
和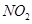 与纯碱反应产生的为
与纯碱反应产生的为 bmol
bmol
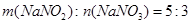
(b)设生成的 为5xmol,
为5xmol,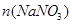 为3xmol
为3xmol
据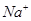 守恒:5x+3x="4 " x=0.5
守恒:5x+3x="4 " x=0.5
 =172.5g,
=172.5g,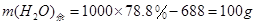
析出: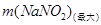 =172.5-71.2=101.3g
=172.5-71.2=101.3g
(2)> ②③
(3) ①

②(a)
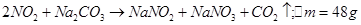
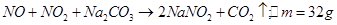
设由
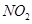 与纯碱反应产生的
与纯碱反应产生的 为amol
为amol由
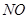 和
和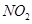 与纯碱反应产生的为
与纯碱反应产生的为 bmol
bmol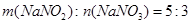
(b)设生成的
 为5xmol,
为5xmol,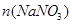 为3xmol
为3xmol据
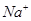 守恒:5x+3x="4 " x=0.5
守恒:5x+3x="4 " x=0.5 =172.5g,
=172.5g,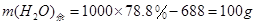
析出:
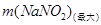 =172.5-71.2=101.3g
=172.5-71.2=101.3g略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 实验方案验证Ag与浓HNO3反应的
实验方案验证Ag与浓HNO3反应的
 液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置
液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置 如上图所示。在B容器中生成硝酸的物质的量为__
如上图所示。在B容器中生成硝酸的物质的量为__
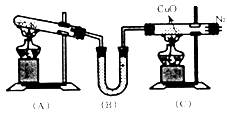
 的气体中可能含有 气体,若要获得较纯的N2,应采用 方法收集。
的气体中可能含有 气体,若要获得较纯的N2,应采用 方法收集。 还原产物是 。
还原产物是 。