题目内容
17.下列叙述正确的是( )| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生白色沉淀 | |
| B. | 已知CuS和FeS都难溶于水,将H2S分别通入CuCl2和FeCl2溶液,都会产生沉淀 | |
| C. | 向AlCl3溶液中滴加NaHCO3溶液,产生白色沉淀;再加入NaHSO4溶液,沉淀可消失 | |
| D. | 形状基本一样的纯净锌块和含铜、铁等杂质的锌块分别与相同浓度的稀硫酸反应纯净的锌块反应产生氢气的速率快 |
分析 A、二氧化碳和二氧化硫均和氯化钡之间不反应;
B、将H2S分别通入CuCl2和FeCl2溶液,根据Qc和Ksp的大小关系确定沉淀是否生成;
C、铝离子和碳酸氢根离子之间可以双水解,氢氧化铝可以和硫酸氢钠之间反应;
D、形成原电池装置的化学反应速率会加快,据此回答.
解答 解:A、将CO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,也不会产生白色沉淀,故A错误;
B、将H2S分别通入CuCl2和FeCl2溶液,根据Qc和Ksp的大小关系,Qc>Ksp会产生沉淀,故B错误;
C、向AlCl3溶液中滴加NaHCO3溶液,产生白色沉淀氢氧化铝;再加入NaHSO4溶液,氢氧化铝可以和硫酸氢钠之间反应,沉淀溶解,故C正确;
D、含铜、铁等杂质的锌块与稀硫酸反应,会因为形成原电池而加快反应速率,所以纯净的锌块反应产生氢气的速率慢,故D错误.
故选C.
点评 本题考查学生含硫化合物的性质以及应用,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
20.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0;一定温度下,向10L恒容密闭容器中通入N2O5,的部分实验数据见下表:
下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| n(N2O5)/mol | 5.00 | 3.5 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为3×10-4mol•L-1•s-1 | |
| B. | 反应达平衡后,往容器中加入5molN2O5气体,平衡正向移动,反应的热效应不变 | |
| C. | 相同温度下,将体积缩小为原来的$\frac{1}{2}$,达到新平衡时,N2O5(g)的浓度为0.125mol/L | |
| D. | 达到新平衡的压强是初始时的1.75倍 |
8.在前一种溶液中慢慢滴加后一种试剂,能观察到先生成沉淀后变澄清的是( )
①氯化铝溶液中滴加氢氧化钠溶液,②偏铝酸钠溶液中加盐酸,③氢氧化钠溶液中滴加氯化铝溶液,④氯化铝溶液中滴加氨水.
①氯化铝溶液中滴加氢氧化钠溶液,②偏铝酸钠溶液中加盐酸,③氢氧化钠溶液中滴加氯化铝溶液,④氯化铝溶液中滴加氨水.
| A. | ①② | B. | ②③④ | C. | ①②④ | D. | ③④ |
5.下列反应的离子方程式正确的是( )
| A. | 金属铁与硫酸铜溶液反应:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 碳酸氢钠溶液与氢氧化钠溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| C. | 氢氧化钡溶液与硫酸溶液反应:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓ | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ |
12.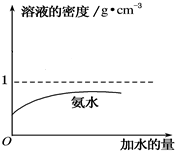 质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )
质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )
 质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )
质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )| A. | c2=2c1 | B. | c2>2c1 | C. | c2<2c1 | D. | 无法确定 |
7.氧化还原反应实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质甲能使上述还原过程发生.则下列说法中正确的是( )
| A. | 物质甲可能是KMnO4 | |
| B. | 总反应中只体现了硝酸的强氧化性 | |
| C. | 反应中若产生3.0 g 气体,则转移电子数为0.3NA | |
| D. | 氧化过程的反应式一定为:Cu2O-2e-+2H+=2Cu2++H2O |
8.已知98%的硫酸物质的量浓度为18.4mol•L-1,则49%的硫酸物质的量浓度是( )
| A. | 小于9.2 mol•L-1 | B. | 等于9.2 mol•L-1 | C. | 大于9.2 mol•L-1 | D. | 不能确定 |