题目内容
12. 质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )
质量分数为a%的氨水,物质的量浓度为c1 mol•L-1,质量分数为2a%的氨水,物质的量浓度为c2 mol•L-1,则c1和c2的数值关系是( )| A. | c2=2c1 | B. | c2>2c1 | C. | c2<2c1 | D. | 无法确定 |
分析 设质量分数为a%的氨水的密度为dg/mL,质量分数为2a%的氨水的密度为Dg/mL,由图可知,氨气的浓度越大,密度越小,则d>D,再根据c=$\frac{1000ρω}{M}$进行判断.
解答 解:设质量分数为a%的氨水的密度为dg/mL,质量分数为2a%的氨水的密度为Dg/mL,
则c1=$\frac{1000d×a%}{17}$,c2=$\frac{1000D×2a%}{17}$,故$\frac{{c}_{1}}{{c}_{2}}$=$\frac{d}{2D}$,
由图可知,氨气的浓度越大,密度越小,则d>D,故c2<2c1,
故选:C.
点评 本题考查物质的量浓度有关计算,难度不大,注意理解掌握物质的量浓度与质量分数关系.

练习册系列答案
相关题目
3.工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)?2NH3(g).
Ⅰ、其部分工艺流程如右图所示,反应体系中各组分的部分性质见下表:

回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.随着温度的升高,K值减小(填增大、减小、不变).平衡常数K值越大,表明AB(填序号).
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程.即反应后通过把混合气体的温度降低到-33.42使NH3分离出来;继续循环的气体是N2、H2.
Ⅱ、在一密闭容器中发生该反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
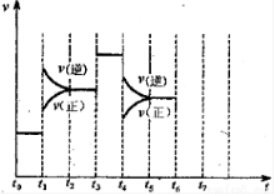
(3)t1、t3、t4时刻分别改变的一个条件是:t1时刻C;t3时刻E;t4时刻B(填选项).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(4)依据(2)中的结论,下列时间段中,氨的百分含量最高的是A(填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
Ⅰ、其部分工艺流程如右图所示,反应体系中各组分的部分性质见下表:

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.随着温度的升高,K值减小(填增大、减小、不变).平衡常数K值越大,表明AB(填序号).
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程.即反应后通过把混合气体的温度降低到-33.42使NH3分离出来;继续循环的气体是N2、H2.
Ⅱ、在一密闭容器中发生该反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:

(3)t1、t3、t4时刻分别改变的一个条件是:t1时刻C;t3时刻E;t4时刻B(填选项).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(4)依据(2)中的结论,下列时间段中,氨的百分含量最高的是A(填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6.
20.${\;}_{53}^{131}$I是常规核裂变产物之一,可以通过测定大气或水中的含量变化来监测核电站是否发生放射性物质泄漏.下列有关有叙述中错误的是( )
| A. | ${\;}_{55}^{131}$I的化学性质与${\;}_{53}^{127}$I是相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
7.下列说法正确的是( )
| A. | 可以用过滤的方法分离FeCl3溶液和Fe(OH)3胶体 | |
| B. | Fe(OH)3胶体静置会分层 | |
| C. | HCl、SO2、Fe2+均既有氧化性又有还原性 | |
| D. | CH3COONH4的电离方程式为:CH3COONH4 CH3COO-+NH4+ |
17.下列叙述正确的是( )
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生,再通入SO2,产生白色沉淀 | |
| B. | 已知CuS和FeS都难溶于水,将H2S分别通入CuCl2和FeCl2溶液,都会产生沉淀 | |
| C. | 向AlCl3溶液中滴加NaHCO3溶液,产生白色沉淀;再加入NaHSO4溶液,沉淀可消失 | |
| D. | 形状基本一样的纯净锌块和含铜、铁等杂质的锌块分别与相同浓度的稀硫酸反应纯净的锌块反应产生氢气的速率快 |
5.一种全天候太阳能电化学电池的工作原理如图所示.下列说法错误的是( )


| A. | 该电池与硅太阳能电池供电原理相同 | |
| B. | 光照时,b极周围pH减小 | |
| C. | 光照时,H+由b极室透过质子膜进入a极室 | |
| D. | 夜间无光照时,a为电池的负极 |
3.相同温度和压强下,1mol CO 和 1mol CO2相比较,下列说法不正确的是( )
| A. | 体积相同,但不一定是22.4 L | B. | 分子数相同,但原子数不同 | ||
| C. | 摩尔质量不同,氧原子个数相同 | D. | 质子数不同,电子数也不同 |
 元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题: .
. .
.