题目内容
【题目】(1)同温同压下,有两瓶体积相等的CO和CO2,这两种气体中所含的分子数目之比为___,所含的原子总数目之比为___,质量比为___,密度之比为___。
(2)在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,
CuSO4+ SO2↑+ 2H2O反应中,
①______元素被氧化,_______是氧化剂。
②用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
③若有2.4mol的H2SO4参与反应,则被还原的H2SO4为___g,生成标况下的二氧化硫气体_______ L,转移电子的数目为_______________。(NA表示阿伏加德罗常数的值)
【答案】 1:1 2:3 7:11 7:11 铜元素,浓硫酸 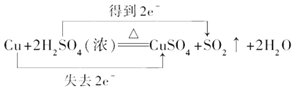 117.6g 26.88L 2.4NA(或者1.4448×1024)
117.6g 26.88L 2.4NA(或者1.4448×1024)
【解析】(1)同温、同压下体积相等的气体,气体的物质的量相等,即分子数目相等,所以CO和CO2分子数目之比为1:1;物质的量相等的CO和CO2所含的原子总数目之比为2:3;物质的量相等的CO和CO2的质量比等于气体的摩尔质量之比,即:28:44=7:11,气体的密度之比等于气体摩尔质量之比,即:28:44=7:11;正确答案:1:1; 2:3 ;7:11;7:11。
(2) ①在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,铜做还原剂,被氧化,浓硫酸做氧化剂,被还原,所以Cu元素被氧化,浓硫酸是氧化剂;正确答案:铜元素;浓硫酸。
CuSO4+ SO2↑+ 2H2O反应中,铜做还原剂,被氧化,浓硫酸做氧化剂,被还原,所以Cu元素被氧化,浓硫酸是氧化剂;正确答案:铜元素;浓硫酸。
②1molCu在反应中失去2mol电子,1mol H2SO4在反应中得到2 mol电子,因此用双线桥标出该反应电子转移的方向和数目如下: ;正确答案:
;正确答案: 。
。
③2molH2SO4(浓) 参与反应,做氧化剂的硫酸为1mol,若有2.4mol的H2SO4参与反应,则被还原的H2SO4为1.2mol,质量为1.2×98=117.6 g;2molH2SO4(浓) 参与反应,生成二氧化硫1mol,若有2.4mol的H2SO4参与反应,生成二氧化硫1.2mol,标况下体积为26.88L;2molH2SO4(浓) 参与反应,转移电子2mol,若有2.4mol的H2SO4参与反应,转移电子数为2.4NA;正确答案:117.6g;26.88L ; 2.4NA(或者1.4448×1024)。




