题目内容
试回答下列问题:
(1)3.01×1023个NH3含
(2)等物质的量的SO2和SO3所含的原子个数之比是
(3)0.4mol NH3中所含氢原子数与
(1)3.01×1023个NH3含
0.5
0.5
mol氨分子,1.5
1.5
mol氢原子.(2)等物质的量的SO2和SO3所含的原子个数之比是
3:4
3:4
,质量比是4:5
4:5
.(3)0.4mol NH3中所含氢原子数与
10.8
10.8
g水所含氢原子数相等.分析:(1)依据n=
;结合分子式计算得到;
(2)物质的量之比等于分子数之比,结合分子式计算原子数之比,根据物质摩尔质量和物质的量之比计算质量之比;
(3)依据微粒数之比等于物质的量之比,结合n=
计算水的质量;
| N |
| NA |
(2)物质的量之比等于分子数之比,结合分子式计算原子数之比,根据物质摩尔质量和物质的量之比计算质量之比;
(3)依据微粒数之比等于物质的量之比,结合n=
| m |
| M |
解答:解:(1)3.01×1023个NH3含物质的量=
=0.5mol,分子数0.5mol,氢原子物质的量为1.5mol;故答案为:0.5mol;1.5mmol;
(2)等物质的量的SO2和SO3所含的原子个数之比是3:4;质量之比=64:80=4:5;故答案为:3:4;4:5;
(3)0.4mol NH3中所含氢原子物质的量为1.2mol;氢原子数之比等于物质的量之比,设水的质量为x,则氢原子物质的量=
×2=1.2mol;
x=10.8g
故答案为;10.8g;
| 3.01×1023 |
| 6.02×1023/mol |
(2)等物质的量的SO2和SO3所含的原子个数之比是3:4;质量之比=64:80=4:5;故答案为:3:4;4:5;
(3)0.4mol NH3中所含氢原子物质的量为1.2mol;氢原子数之比等于物质的量之比,设水的质量为x,则氢原子物质的量=
| x |
| 18g/mol |
x=10.8g
故答案为;10.8g;
点评:本题考查了物质的量与微粒数、质量的计算应用,主要是微粒物质的量之比和微粒数之比相同,题目较简单.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
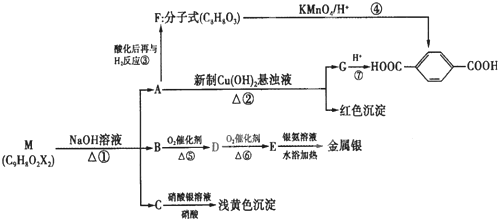










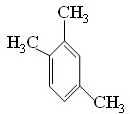
 、
、


 已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作:
已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作: