题目内容
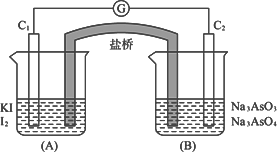
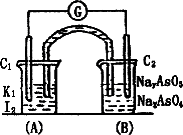
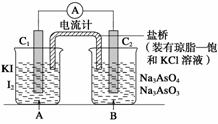
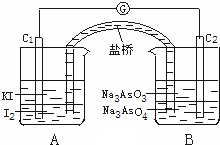 已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作:
已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安表指针偏转;
(Ⅱ)若改向(B)烧杯中滴加40% NaOH溶液,发现微安表指针向前述相反方向偏转.
试回答下列问题:
(1)两次操作过程中微安表指针为什么会发生偏转?
两次操作过程均能形成原电池,都是把化学能转化为电能
两次操作过程均能形成原电池,都是把化学能转化为电能
(2)两次操作过程中指针偏转方向为什么相反?
操作1中C1是负极,C2是正极;操作2中C1是正极,C2是负极
操作1中C1是负极,C2是正极;操作2中C1是正极,C2是负极
(3)(Ⅰ)操作过程中,C1棒发生的反应为
2I--2e-=I2
2I--2e-=I2
(4)(Ⅱ)操作过程中,C2棒发生的反应为
AsO33-+H2O-2e-=AsO43-+2H+
AsO33-+H2O-2e-=AsO43-+2H+
.分析:由图可知,该装置为原电池,(Ⅰ)发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,电极反应发生2I--2e-=I2;
(Ⅱ)发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,以此来解答.
(Ⅱ)发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,以此来解答.
解答:解:由图可知,该装置为原电池,(Ⅰ)发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,电极反应发生2I--2e-=I2;
(Ⅱ)发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,
(1)因两次操作过程均能形成原电池,都是把化学能转化为电能,形成电流指针偏转,故答案为:两次操作过程均能形成原电池,都是把化学能转化为电能;
(2)因操作1中C1是负极,C2是正极;操作2中C1是正极,C2是负极,电子由负极流向正极,则指针偏转方向不同,
故答案为:操作1中C1是负极,C2是正极;操作2中C1是正极,C2是负极;
(3)C1棒为负极,电极反应发生2I--2e-=I2,故答案为:2I--2e-=I2;
(4)C2棒为负极,电极反应为AsO33-+H2O-2e-=AsO43-+2H+,故答案为:AsO33-+H2O-2e-=AsO43-+2H+.
(Ⅱ)发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,
(1)因两次操作过程均能形成原电池,都是把化学能转化为电能,形成电流指针偏转,故答案为:两次操作过程均能形成原电池,都是把化学能转化为电能;
(2)因操作1中C1是负极,C2是正极;操作2中C1是正极,C2是负极,电子由负极流向正极,则指针偏转方向不同,
故答案为:操作1中C1是负极,C2是正极;操作2中C1是正极,C2是负极;
(3)C1棒为负极,电极反应发生2I--2e-=I2,故答案为:2I--2e-=I2;
(4)C2棒为负极,电极反应为AsO33-+H2O-2e-=AsO43-+2H+,故答案为:AsO33-+H2O-2e-=AsO43-+2H+.
点评:本题考查电解池和原电池,明确电解质的不同发生的电池反应不同是解答本题的关键,并熟悉原电池和电解池的工作原理来解答即可,题目难度中等.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
 AsO
AsO