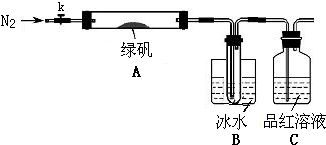
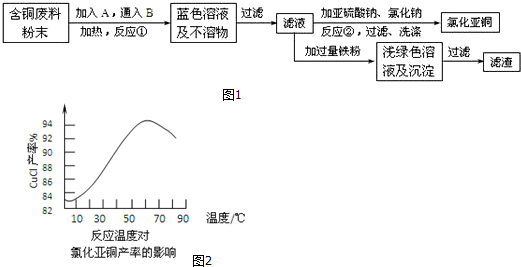
题目内容
13. 按要求回答下列问题:
按要求回答下列问题:(1)实验室铝粉和Fe2O3作铝热反应实验,铝热反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该实验中除用到铝粉和Fe2O3外,需要的试剂还有ab(填编号).a.KClO3 b.Mg c.MnO2 d.KCl
(2)据文献报道,在实际反应中铝热反应的产物成分较为复杂.某课题组对铝热反应产物的成分进行探究,经成分分析,发现主要得到甲和乙两种产物.甲由具有相同电子层结构的阴、阳离子构成;乙是一种铁铝的金属互化物(可用FexAly表示),取该合金粉末2.47g,滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体.再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g.
①甲的化学式为Al2O3,乙的组成可表示为Fe2Al5.
②甲的晶体是耐高温材料,用此材料做成的坩埚,不能用来熔融NaOH,用化学方程式解释其原因Al2O3+2NaOH+3H2O═2Na[Al(OH)]4;
含二氧化硅材料做成的坩埚不能(填“能”或“不能”)用来熔融NaOH.
③如图表示室温下相同组分的乙分别在两种不同的酸中的腐蚀情况,由图可知,乙在65%浓硝酸中具有比较强的抗腐蚀性,原因可能是遇浓硝酸表面钝化,阻碍进一步反应(只要体现出“钝化”即可).
分析 (1)铝与氧化铁发生铝热反应生成氧化铝和铁,据此写出反应的化学方程式;该实验中除用到铝粉和Fe2O3外,需要的试剂还有氯酸钾和镁;
(2)①甲由具有相同电子层结构的阴、阳离子构成,则甲为Al2O3;灼烧得到的红棕色粉末1.60g应该是氧化铁,计算出氧化铁的物质的量,根据铁原子守恒可知铁的物质的量是及质量,从而得出合金中铝的质量,根据n=$\frac{m}{M}$计算出铝物质的量,就可以得出x:y,从而得出乙的化学式;
②在加热的条件下氧化铝与氢氧化钠反应生成Na[Al(OH)]4;由于二氧化硅与能与氢氧化钠反应生成硅酸钠和水,所以含二氧化硅材料做成的坩埚不能用来熔融NaOH;
③结合图象可知乙在65%浓硝酸中具有比较强的抗腐蚀性,这是由于常温下遇浓硝酸表面钝化,阻碍进一步反应.
解答 解:(1)铝与氧化铁发生铝热反应的方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;该实验中除用到铝粉和Fe2O3外,需要的试剂还有氯酸钾和镁,故ab正确,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;ab;
(2)①甲由具有相同电子层结构的阴、阳离子构成,则甲是Al2O3;取该合金粉末2.47g,滴加足量浓NaOH溶液,其中铝溶解转化为偏铝酸钠,充分搅拌、过滤、洗涤得固体铁.再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g,所以红棕色粉末应该是氧化铁,物质的量为:$\frac{1.60g}{160g/mol}$=0.01mol;根据铁原子守恒可知铁的物质的量是0.02mol,质量是0.02mol×56g/mol=1.12g,因此合金中铝的质量是2.47g-1.12g=1.35g,物质的量为:$\frac{1.35g}{27g/mol}$=0.05mol,所以x:y=0.02:0.05=2:5,则乙的化学式为Fe2Al5,
故答案为:Al2O3;Fe2Al5;
②在加热的条件下氧化铝与氢氧化钠反应,反应的化学方程式为:Al2O3+2NaOH+3H2O═2Na[Al(OH)]4;
二氧化硅与能与氢氧化钠反应生成硅酸钠和水,所以含二氧化硅材料做成的坩埚不能用来熔融NaOH,
故答案为:Al2O3+2NaOH+3H2O═2Na[Al(OH)]4;不能;
③根据图象可知乙在65%浓硝酸中具有比较强的抗腐蚀性,这是由于常温下遇浓硝酸表面钝化,阻碍进一步反应,
故答案为:65%浓硝酸;遇浓硝酸表面钝化,阻碍进一步反应(只要体现出“钝化”即可).
点评 本题考查金属镁、铝、铁等有关性质与计算,题目难度中等,注意掌握铝热反应原理及操作方法,明确常见金属单质及其化合物性质,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案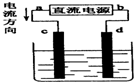
| A. | 电解过程中,d电极附近溶液变红 | |
| B. | c电极上的电极反应式为:2H++2e-=2H2↑ | |
| C. | a为负极、d为阳极 | |
| D. | 电解过程中,氯离子浓度不变 |
aA(g)+bB(g)?2C(g)
起始浓度(mol/L) 3.0 1.0 0
2s末浓度(mol/L) 1.8 0.6 0.8
据此可推算出上述方程式中各物质的计量数之比是( )
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
| A. | 检验试液中的SO42-:试液$\stackrel{BaCl_{2}溶液}{→}$ 白色沉淀$\stackrel{HCl溶液}{→}$ 白色沉淀 | |
| B. | 检验试液中的Cl-:试液$\stackrel{稀H_{2}SO_{4}}{→}$无沉淀$\stackrel{AgNO_{3}溶液}{→}$ 白色沉淀 | |
| C. | 检验试液中的Fe2+:试液$\stackrel{氯水}{→}$无明显现象$\stackrel{KSCN溶液}{→}$血红色溶液 | |
| D. | 检验试液中的NH4+:试液$→_{供热}^{NaOH溶液}$气体逸出$→_{石蕊试纸}^{湿润的红色}$ 试纸变蓝 |
| A. | H-OH | B. | CH3OH | C. |  | D. | CH3OCH3 |
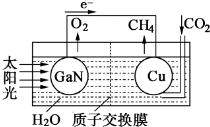 ,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(填“盐酸”或“硫酸”).
,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(填“盐酸”或“硫酸”).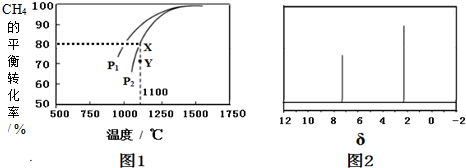
 .(相对原子量:C-12 H-1)
.(相对原子量:C-12 H-1)