题目内容
将a moL/L的Na2CO3溶液与b mol/L的NaHCO3溶液等体积混合,所得溶液中粒子浓度间的关系及相关判断不正确的是( )
A.c(Na+)+c(H+)>c(CO32-)+c(HCO3-)+c(OH-)
B.c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3)
C.若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则一定a<b
D.若c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c(H2CO3),则可确定a=b
【答案】
C
【解析】

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0) Si3N4(s) +
12HCl(g) △H<0
Si3N4(s) +
12HCl(g) △H<0  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0) 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定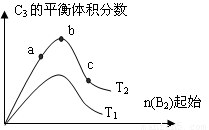 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变