题目内容
【题目】一定条件下,CO2与NH3反应可制得重要的化工产品三聚氰胺:3NH3 + 3CO2![]()
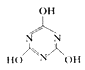 +3H2O。
+3H2O。
(1)基态N原子的价层电子排布图为____________,三聚氰胺的几种组成元素中,第一电离能最大的元素是____________(填元素符号),电负性由大到小的顺序为____________(用元素符号表示)。
(2)三聚氰胺中氮原子、碳原子的杂化轨道类型分别为____________,NH3、CO2、H2O三种分子中化学键的键角由大到小的顺序为____________。
(3)上述四种分子中所有原子一定共平面的是____________,反应过程中存在多种类型化学键的断裂与形成,但这些化学键中不包括____________(填选项字母)。
a.α键 b.π键 c.非极性共价键 d.极性共价键
(4)三聚氰胺的熔点为250 ℃,则其晶体类型是____________,又知硝基苯的熔点为5.7 ℃,异致这两种物质熔点差异的原因是____________。
(5)随者科学技术的发展,科学家们已合成了由碳、氧两种元素形成的原子晶体.其晶胞结构如图所示:

①该晶体的化学式为____________,晶体中氧原子的配位数是____________。
②若晶胞参数为a pm,设NA表示阿伏加德罗常数的值,则该晶胞的密度是____________ g cm-3。
【答案】 ![]() N O>N>C>H sp2、sp2 CO2>NH3>H2O CO2、H2O c 分子晶体 三聚氰胺分子间可形成氢键而硝基苯不能 CO2 2
N O>N>C>H sp2、sp2 CO2>NH3>H2O CO2、H2O c 分子晶体 三聚氰胺分子间可形成氢键而硝基苯不能 CO2 2 ![]()
【解析】(1)基态N原子的价层电子排布式为2s22p3,所以电子排布图为![]() ,三聚氰胺的几种组成元素中,因为N的2p轨道是半充满状态较稳定,所以第一电离能最大的元素是N,一般非金属性越强电负性越大,电负性由大到小的顺序为O>N>C>H。
,三聚氰胺的几种组成元素中,因为N的2p轨道是半充满状态较稳定,所以第一电离能最大的元素是N,一般非金属性越强电负性越大,电负性由大到小的顺序为O>N>C>H。
(2)三聚氰胺中氮原子、碳原子都形成了一个![]() 键,所以它们的杂化轨道类型都是sp2, CO2为直线形,键角为180
键,所以它们的杂化轨道类型都是sp2, CO2为直线形,键角为180![]() ,H2O和NH3的中心原子都是sp3杂化,NH3分子中N有一对孤对电子而水分子中O有两对孤对电子,根据价层电子对互斥理论,三种分子中化学键的键角由大到小的顺序为CO2>NH3>H2O。
,H2O和NH3的中心原子都是sp3杂化,NH3分子中N有一对孤对电子而水分子中O有两对孤对电子,根据价层电子对互斥理论,三种分子中化学键的键角由大到小的顺序为CO2>NH3>H2O。
(3)上述四种分子中所有原子一定共平面的是CO2、H2O,4种分子中都没有非极性键,所以无非极性键的断裂与形成。
(4)三聚氰胺的熔点较低,其晶体类型是分子晶体,硝基苯的熔点为5.7 ℃,异致这两种物质熔点差异的原因是三聚氰胺分子间可形成氢键而硝基苯不能。
(5)由碳、氧两种元素形成的原子晶体.其晶胞结构和我们熟悉的二氧化硅相似。
①每个晶胞中含有8个C原子、16个O原子,所以该晶体的化学式为CO2,晶体中每个O与相邻的两个C原子成键,所以氧原子的配位数是2。
②每个晶胞中含有8个C原子、16个O原子,该晶胞的相对质量为352.若晶胞参数为a pm,则NA个晶胞的质量为352 g、体积为![]() 则该晶胞的密度是
则该晶胞的密度是![]() g cm-3。
g cm-3。

 优百分课时互动系列答案
优百分课时互动系列答案