题目内容
已知下列元素的原子半径:
| 元素 | N | S | O | Si |
| 原子半径/10?-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10?-10m B.1.10×10?-10 m
C.1.20×10-10 m D.0.70×10?-10m
B
解析试题分析:同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大。据此可知,P的原子半径小于硅的原子半径,但大于S的原子半径,所以根据表中数据可知,选项B正确,答案选B。
考点:考查原子半径的大小比较
点评:该题是中等难度的试题,主要是考查学生灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确原子半径的递变规律,然后结合题意灵活运用即可。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4)
(2009?宿迁二模)聚合铁(简称PFS)化学式为:[Fe2(OH)n(SO4) (2012?揭阳一模)已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如下图,下列说法正确的是( )
(2012?揭阳一模)已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如下图,下列说法正确的是( ) ]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子. 
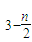 ]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子. 
 ]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子.
]m,n<5,m<10.现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子. 