题目内容
20.在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g)?3C(g)+2D(g),达到平衡状态的是( )| A. | 混合气的平均相对分子质量不再改变 | |
| B. | 反应器内A、B、C、D物质的量比为1:3:3:2 | |
| C. | 容器内密度不随时间变化而变化 | |
| D. | 生成 1mol A同时有3 mol C被消耗 |
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:A、混合气体的平均相对分子质量=$\frac{混合气体的质量总和}{混合气体的物质的量总和}$,反应前后气体物质的量不同,质量不变,所以混合气体的平均相对分子质量不变说明各组分物质的量不变,反应达到平衡状态,故A正确;
B、平衡时各物质的物质的量之比取决于物质的起始物质的量和转化率,故反应器内A、B、C、D物质的量比为1:3:3:2不能作为判断是否达到平衡状态的依据,故B错误;
C、容器体积不变,混合气体的质量不变,故密度不随时间改变不能作为判断是否达到化学平衡状态的依据,故C错误;
D、生成 1mol A为逆反应,同时有3 mol C被消耗也是逆反应,故不能说明达到平衡状态,故D错误,
故选A.
点评 本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
10.铍的性质类似于铝,下列有关铍性质和结构的推断正确的是( )
| A. | 铍与铝原子核外具有相同的未成对电子数 | |
| B. | 氢氧化铍能与强酸、强碱溶液反应 | |
| C. | 铍与铝元素具有相同的最高正化合价 | |
| D. | 氧化铍只溶于强酸溶液,不溶于强碱溶液 |
11.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:B、氧,C、钠,D、铝,E、氯;
(2)写出A、B、C形成的化合物M的电子式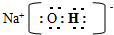 ;
;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(4)E单质与M的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:B、氧,C、钠,D、铝,E、氯;
(2)写出A、B、C形成的化合物M的电子式
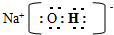 ;
;(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(4)E单质与M的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
15.NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 含0.1NA个 H的H2O中,O的质量为0.8g | |
| B. | 0.012kg C所含的C数为NA | |
| C. | 98g H2SO4溶于2L水,取其中500mL,溶液中c(H+)为1mol/L | |
| D. | 通常状况下,1mol H2O的体积小于22.4L |
5.下列物质溶于水形成的溶液能导电,但本身是非电解质的是( )
| A. | NaOH | B. | Na2SO4 | C. | SO3 | D. | CH3CH2OH |
12.下列说法正确的是( )
| A. | 按分散剂种类可将分散系分为溶液、胶体和浊液 | |
| B. | 漂白粉、钢、氯水、Fe(OH)3胶体均为混合物 | |
| C. | 过氧化氢与过氧化钠中含有化学键的类型完全相同 | |
| D. | KNO3溶液、铜、熔融的NaCl均能导电,都属于电解质 |
9.下列有关钠、镁、铝、铁的性质的叙述错误的是( )
| A. | Na与O2加热时反应生成Na2O2 | |
| B. | 向镁与热水反应后的溶液中滴加酚酞,溶液变为红色 | |
| C. | 日常用的铝制品表面总是覆盖着保护膜,起着保护内部金属的作用 | |
| D. | 铁能与水蒸气能反应,生成Fe2O3和H2 |
6.下列建筑物在酸雨的环境下,最不容易被腐蚀的是( )
| A. |  乐山大佛 | B. |  开封铁塔 | ||
| C. |  故宫前的铜狮子 | D. |  华岩寺露天金佛 |
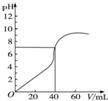 25℃时,用1.0mol•L-1 NaOH溶液中和某浓度H2SO4溶液40mL,其pH和所加NaOH溶液的体积关系如图所示.求:(写出必要的解题过程)
25℃时,用1.0mol•L-1 NaOH溶液中和某浓度H2SO4溶液40mL,其pH和所加NaOH溶液的体积关系如图所示.求:(写出必要的解题过程)