题目内容
【题目】磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的三种方法。回答下列问题:
I.直接法
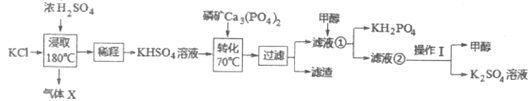
(1)气体X为___________(填化学式);
(2)“浸取”步骤,浓硫酸能与KCl能发生化学反应的原因是___________________;
(3)“转化”步骤发生反应的离子反应方程式_______________(已知:Ca3(PO4)2难溶于水);
(4)滤液①中加入甲醇的作用是__________________________;
(5)“操作I”是___________________________________;
II.中和反应法
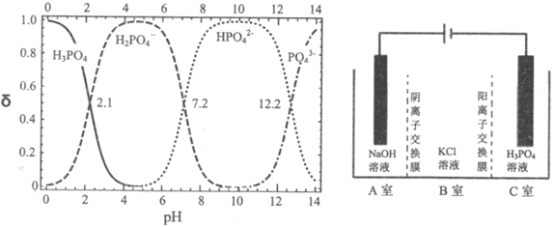
(6)氢氧化钾溶液与高纯度磷酸在反应器中发生中和反应制备磷酸二氢钾。写出此反应的离子反应方程式_______________________________;由下图判断制备磷酸二氢钾(达80%)的最佳pH范围______________________;
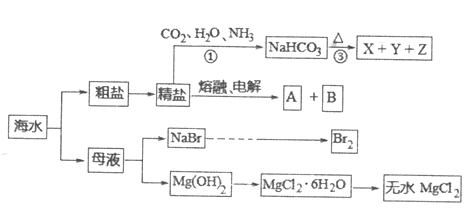
Ⅲ.电解法制取KH2PO4的原理如上图所示。一定条件下,还可得到NaClO3。
(7)在_____室(填标号)可得到KH2PO4;写出产生ClO3-的电极反应式______________。
【答案】HCl 有(HCl)气体生成,使化学平衡向正反应方向移动 Ca3(PO4)2+4H++2SO42-=CaSO4+2H2PO4- 促进KH2PO4析出 蒸馏 H3PO4+OH-=H2PO4-+H2O 3~6.5 C Cl-+6OH--6e-=ClO3-+3H2O
【解析】
Ⅰ.浓硫酸与KCl发生复分解反应产生硫酸氢钾和HCl,在70℃条件下,向KHSO4溶液加入Ca3(PO4)2发生反应产生KH2PO4、CaSO4、K2SO4,过滤,除去CaSO4,向滤液①中加入甲醇,可以降低KH2PO4的溶解度,得到产品磷酸二氢钾晶体,由于甲醇沸点低,而水的沸点高,所以通过蒸馏将甲醇与K2SO4的水溶液分离,得到K2SO4。氢氧化钾溶液与高纯度磷酸在反应器中发生中和反应制备磷酸二氢钾和水,根据磷酸二氢钾的含量与溶液的pH关系判断最佳pH范围;C室连接电源负极得到电子做阴极,阳离子钾离子通过阳离子交换膜进入C室,得到产品磷酸二氢钾,氯离子通过阴离子交换膜在A室失去电子发生氧化反应,据此分析。
Ⅰ.(1)由流程可知,KCl与浓硫酸得到KHSO4,则得到的气体为HCl;
(2)“浸取”步骤,浓硫酸能与KCl能发生反应是由于H2SO4(浓)+KCl![]() KHSO4+HCl↑,反应产生的HCl脱离平衡体系,减小了生成物的浓度,平衡正向移动,逐渐发生反应,由硫酸变为挥发性的HCl;
KHSO4+HCl↑,反应产生的HCl脱离平衡体系,减小了生成物的浓度,平衡正向移动,逐渐发生反应,由硫酸变为挥发性的HCl;
(3)由流程可知在70℃条件下, KHSO4溶液加入Ca3(PO4)2可以转化得到KH2PO4,同时得到CaSO4,该反应的离子方程式为:Ca3(PO4)2+4H++2SO42-=CaSO4+2H2PO4-;
(4)滤液①中加入甲醇得到产品磷酸二氢钾,说明甲醇的作用是降低磷酸二氢钾的溶解度,促进磷酸二氢钾的析出;
(5)由于甲醇沸点低,而水的沸点高,所以操作Ⅰ是蒸馏,通过蒸馏将甲醇与K2SO4的水溶液分离,得到K2SO4;
Ⅱ.(6)磷酸是三元弱酸,与KOH溶液按1:1物质的量关系发生反应,在反应器中发生中和反应制备磷酸二氢钾和水。该反应的离子反应方程式H3PO4+OH-=H2PO4-+H2O;
根据磷酸二氢钾的含量与溶液的pH关系图可知:要制备含量达80%磷酸二氢钾,最佳pH范围是3~6.5;
Ⅲ.C室连接电源负极,作阴极,获得电子,发生还原反应,阳离子K+通过阳离子交换膜进入C室,与C室的H2PO4-结合为KH2PO4,得到产品磷酸二氢钾,Cl-则通过阴离子交换膜进入A室,在A室Cl-失去电子发生氧化反应得到ClO3-,电极反应式为: Cl-+6OH--6e-=ClO3-+3H2O。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案