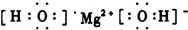题目内容
A、B、C、D均为短周期元素,C元素原子最外层电子数是内层电子数的3倍,A和C可形成两种化合物X和Y,X和水反应后生成一种具有不稳定性且有还原性的二元酸M。B和C可化合生成Z,1 mol Z在加热条件下跟水反应的产物需用6 mol KOH才能完全中和。B元素组成的单质和D元素组成的单质在一定条件下反应生成化合物N,N和水反应可生成W和D元素的气态氢化物,W是B元素的最高价氧化物对应的水化物。试回答下列问题:(1)写出下列元素符号:A____________;B____________;C____________;D____________。
(2)写出下列化合物的化学式:X____________;Y____________;Z____________。
(3)写出下列反应的化学方程式:
N和水反应:________________________________________________;
B的单质+Y![]() X+Z:____________________________________________。
X+Z:____________________________________________。
解析:由C元素最外层电子数是内层电子数的3倍,可知C为氧元素。常见的能与水反应生成酸的氧化物应该为非金属氧化物,中学化学中所涉及的具有“不稳定性”且有“还原性”的二元酸为亚硫酸(H2SO3),据此可推知X为SO2,A元素为硫,与X的组成元素相同的Y必定为SO3。因1molZ与水反应(必须在加热时进行)的产物能被6mol氢氧化钾完全中和,故Z必为酸性氧化物即酸酐,在中学化学中仅有P2O5符合,因1molP2O5和热水反应生成2molH3PO4,而2molH3PO4需6molKOH才能完全中和,故可推出W为H3PO4,B为磷元素。
答案:(1)S P O Cl
(2)SO2 SO3 P2O5
(3)PCl5+4H2O![]() H3PO4+5HCl
H3PO4+5HCl
2P+5SO3![]() 5SO2+P2O5
5SO2+P2O5

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
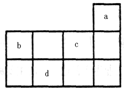 a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )
a、b、c、d均为短周期元素,它们在周期表中的位置如图所示.下列说法正确的是( )| A、a原子的最外电子层上有8个电子 | B、c的最高价氧化物对应水化物为强酸 | C、d的原子半径比c的大 | D、b的非金属性比c的强 |


 A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素:A、B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不是同周期,也不同主族.请回答:
 NH3?H2O+H+
NH3?H2O+H+ 2NH3
2NH3