题目内容
8.现有下列物质:a.石墨 b.CO2 c.CaO d.H2SO4 e.稀盐酸 f.Ba(OH)2
g.固体纯碱 h.稀豆浆 i.Fe(OH)3 j.NaCl溶液 k.H2O
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 所属类别 | 混合物 | 碱 | 溶液 | 胶体 | 电解质 |
| 物质编号 | ① | ② | ③ | ④ | ⑤ |
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式:HCO3-+H+═H2O+CO2↑;如果病人同时患胃溃疡,不能服用小苏打,原因是:小苏打与胃酸作用产生大量CO2,会刺激溃疡面,易引起胃穿孔;此时最好用含氢氧化铝的胃药(如斯达舒)离子方程式:Al(OH)3+3H+═Al3++3H2O.
分析 (1)混合物是不同分子构成的物质;碱是指电离出的阴离子全部是氢氧根离子的化合物;溶液是混合物,胶体属于混合物;电解质是在水溶液或是熔融状态下能导电的化合物;
(2)含有自由移动的离子或是电子的物质可以导电;
(3)胃酸的成分盐酸可以和小苏打之间反应生成二氧化碳,氢氧化铝属于两性氢氧化物,能和杨酸之间反应.
解答 解:(1)①e.稀盐酸h.稀豆浆j.NaCl溶液是不同分子构成的物质,属于混合物,f.Ba(OH)2i.Fe(OH)3电离出的阴离子全部是氢氧根离子,属于碱;e.稀盐酸j.NaCl溶液属于溶液;h.稀豆浆 属于胶体分散系;c.CaOd.H2SO4f.Ba(OH)2g.固体纯碱i.Fe(OH)3k.H2O是在水溶液或是熔融状态下能导电的化合物,属于电解质,
故答案为:①e、h、j②f、i③e、j④h⑤c、d、f、g、i、k;
(2)e.稀盐酸j.NaCl溶液含有自由移动的离子,可以导电,故答案为:e、j;
(3)胃酸的成分盐酸可以和小苏打之间反应生成二氧化碳,即HCO3-+H+═H2O+CO2↑,由于小苏打与胃酸作用产生大量CO2,会刺激溃疡面,易引起胃穿孔,含氢氧化铝的胃药可以和盐酸之间反应:Al(OH)3+3H+═Al3++3H2O,
故答案为:HCO3-+H+═H2O+CO2↑;小苏打与胃酸作用产生大量CO2,会刺激溃疡面,易引起胃穿孔;Al(OH)3+3H+═Al3++3H2O.
点评 本题考查学生物质的分类以及离子的方程式的书写知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产 物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 氧化性由强到弱顺序为MnO4->C12>Fe3+>Br2 | |
| B. | 第①组反应的氧化产物为O2 | |
| C. | 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1:2 | |
| D. | 第③组反应中生成1mol Cl2,转移电子2mol |
19.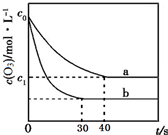 臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )
臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )
 臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )
臭氧的脱硝反应为:2NO2(g)+O3(g)═N2O5(g)+O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0mol NO2和1.0mol O3,一段时间后达到平衡.下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化.下列叙述正确的是( )| A. | 反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△S<0 | |
| B. | 曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb | |
| C. | 曲线b对应的条件改变可能是密闭容器的体积变为4.0 L | |
| D. | 若c1=0.3mol•L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol•L-1•s-1 |
16.ClO2是一种高效安全的绿色杀菌剂,下列有关ClO2制备与杀菌的说法不合理的是( )
| A. | 可用Cl2和NaClO3制备ClO2,其中n (氧化剂):n (还原剂)=1:2 | |
| B. | ClO2在强碱性环境中使用失效:2ClO2+2OH-═ClO3-+ClO2-+H2O | |
| C. | ClO2处理饮用水时残留的ClO2-,可用FeSO4来除去:ClO2-+2Fe2++4H+═2Fe3++Cl-+2H2O | |
| D. | 等物质的量的ClO2杀菌效果比Cl2、HClO强 |
3.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②常温常压下,8gCH4含有的电子数为5NA
③0.5mol/L硫酸钠溶液中含有的Na+数为NA
④标准状况下,4.48L CCl4所含的原子数为NA
⑤32g O2和O3混合气体中含有原子数为2NA.
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②常温常压下,8gCH4含有的电子数为5NA
③0.5mol/L硫酸钠溶液中含有的Na+数为NA
④标准状况下,4.48L CCl4所含的原子数为NA
⑤32g O2和O3混合气体中含有原子数为2NA.
| A. | ①②③ | B. | ①②⑤ | C. | ②③⑤ | D. | ③④⑤ |
13.反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )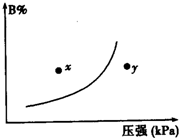
①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大.

①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大.
| A. | ①②⑤ | B. | ②④⑤ | C. | 只有①③ | D. | ①③⑤ |
20.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 在恒容的密闭容器中充入1molN2和3molH2,一定条件下发生反应,下列说法正确的是( )
| A. | 平衡后,缩小容器的容积,N2的浓度增大 | |
| B. | 平衡后,再向容器中充入1mol氦气,N2的转化率增大 | |
| C. | 平衡前,随着反应的进行,容器内气体密度逐渐增大 | |
| D. | 平衡时,该反应放出的热量为92.4kJ |
17.下列反应是氧化还原反应,且反应的焓变大于零的是( )
| A. | 铝片与稀H2SO4反应 | B. | Ba( OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2反应 | D. | 甲烷在O2中的燃烧反应 |
 氮化铝(AIN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al203在
氮化铝(AIN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:①Al203在