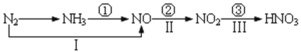
题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑩ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是____________,碱性最强的化合物的化学式是______________________________。
(3)最高价氧化物是两性氧化物的元素是__________;写出它的氧化物与氢氧化钠反应的离子方程_________________________________________________。
(4)元素②形成的气态氢化物为_______________________(填化学式),检验该气体的方法为________________。
(5)原子半径最大的是_______(填元素符号),①②③三种元素气态氢化物稳定性由强到弱:____>____>____(填化学式,下同)。
(6) ④和⑤⑩三种元素最高价氧化物的水化物的碱性由强到弱顺序的是:____>____>____。
(7)④⑨和⑩三种元素所形成的简单离子的半径大小次序是:_______<_______<________。
【答案】Ar HClO4 KOH Al Al2O3+2OH-=2![]() +H2O NH3 用湿润的红色石蕊试纸(变蓝)检验或用蘸有浓盐酸的玻璃棒靠近瓶口,观察是否有白烟产生进行检验 K H2O NH3 CH4 NaOH Mg(OH)2 Al(OH)3 Mg2+ Na+ K+
+H2O NH3 用湿润的红色石蕊试纸(变蓝)检验或用蘸有浓盐酸的玻璃棒靠近瓶口,观察是否有白烟产生进行检验 K H2O NH3 CH4 NaOH Mg(OH)2 Al(OH)3 Mg2+ Na+ K+
【解析】
根据周期表中元素的位置关系,可知①为C元素,②为N元素,③为O元素,④为Na元素,⑤为Al元素,⑥为S元素,⑦为Cl元素,⑧是Ar元素,⑨为K元素,⑩为Mg元素,据此进行分析。
(1)在元素周期表中,0族元素原子最外层已达2电子或8电子稳定结构,化学性质不活泼,故答案为:Ar;
(2)根据同一周期,从左至右非金属性逐渐增强,其最高价氧化物对应水化物的酸性也逐渐增强;同一主族,从上至下,金属性逐渐增强,其最高价氧化物对应水化物的碱性也逐渐增强,可知,HClO4的酸性最强,KOH的碱性最强。答案为:HClO4;KOH;
(3)Al2O3既能与酸反应,也能与碱反应,故Al2O3为两性氧化物。Al2O3与NaOH反应生成NaAlO2和H2O,离子方程式为:Al2O3+2OH-=2![]() +H2O;答案为:Al;Al2O3+2OH-=2
+H2O;答案为:Al;Al2O3+2OH-=2![]() +H2O;
+H2O;
(4)由分析可知,②为N元素,其气态氢化物为NH3,NH3可使湿润的红色石蕊试纸变蓝,可与浓盐酸反应,生成NH4Cl,有白烟产生,故可用这两种方法进行检验。答案为:NH3;用湿润的红色石蕊试纸(变蓝)检验或用蘸有浓盐酸的玻璃棒靠近瓶口,观察是否有白烟产生进行检验;
(5)根据同一周期从左到右,原子半径逐渐减小,同一主族从上到下,原子半径逐渐增大,可知原子半径最大的是K;同一周期,非金属性:C<N<O,则其气态氢化物的稳定性为:H2O>NH3>CH4,答案为:K;H2O;NH3;CH4;
(6)同一周期元素的金属性:Na>Mg>Al,则其最高价氧化物对应水化物的碱性:NaOH>Mg(OH)2>Al(OH)3。答案为:NaOH;Mg(OH)2;Al(OH)3;
(7)电子层结构相同的离子,核电荷数越大,半径越小,可知离子半径:Na+>Mg2+;根据带相同电荷的离子,电子层数越多,半径越大,可知离子半径:K+>Na+,故离子半径大小次序是:Mg2+<Na+<K+。答案为:Mg2+;Na+;K+。

 名校课堂系列答案
名校课堂系列答案