题目内容
已知2X2(g)+Y2(g) = 2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2,在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
⑴此反应平衡常数表达式为_________________;若将温度降低到300℃,则反应平衡常数将___________(填增大、减少或不变)。
⑵若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度_______Wmol·L—1(填“>”、“<”或“=”),a、b、c之间满足关系___________(用代数式表示)。
⑶能说明反应已达平衡状态的是___________________。
A.浓度c(Z)=2c(Y2) B.容器内压强保持不变
C.v逆(X2)=2v正(Y2) D.容器内的密度保持不变
⑷若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将_____(填“变大”、“变小”或“不变”)。
(1)K=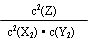 ;增大
;增大
(2)= ; a =" b" + c
(3)BC
(4)变大
【解析】
试题分析:(1)平衡常数的表达式为:K=c2(Z)/ c2(X2) c2(Y2),该反应的正反应是放热反应,故降低温度,平衡常数增大。(2)恒温恒容条件下在容器中加入2mol Z,500℃充分反应达平衡后和之前建立的平衡等效,故Z浓度等于Wmol·L—1,a是该可逆反应放出的总的热量,所以a =" b" + c (3)A选项要代表反应达到平衡则应该是浓度的变化△c(Z)=2△c(Y2)。B选项该反应是在恒容容器中进行,而且是一个不等体积反应,故压强不变可作为该反应达到平衡的标志。C选项v逆(X2)=2v正(Y2) 可作为该反应达到平衡的标志,D选项由于是在恒容容器中进行,而密度=质量÷体积,质量和体积在反应前后均没有发生变化,所以密度不变不能作为反应达到平衡的依据。(4)如果改在恒压容器中,随着反应的进行,容器的体积在减小,导致压强增大,反应正向移动,和在恒容条件下相比,达到平衡后Y2的转化率增大。
考点:化学平衡平衡状态的判断,等效平衡
点评:化学平衡这一块的内容对于学生来说是一个难点,但是本题考察的知识点较为简单,是平衡题目常考题目,不需要学生进行深入地分析,基础的知识点要理解性的记忆,需要熟练掌握。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
 键的键数之比为 ,其化学性质 (填“活泼”或“稳定”):
键的键数之比为 ,其化学性质 (填“活泼”或“稳定”):
 键的键数之比为 ,其化学性质
(填“活泼”或“稳定”):
键的键数之比为 ,其化学性质
(填“活泼”或“稳定”):