��Ŀ����
����Ŀ��ijС��ͬѧ���о�SO2�����ʣ�
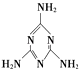
��1������صĺ������ʷ�Ϊ���±���ʾ3�飬��2��������X�Ļ�ѧʽ�� ��
��1�� | ��2�� | ��3�� |
S�����ʣ� | SO2��X��Na2SO3��NaHSO3 | SO3��H2SO4��Na2SO4��NaHSO4 |
��2��������ͼ��ʾ��װ���о�SO2�����ʣ� 
���۵㣺SO2 76.1�棬SO3 16.8�棻�е㣺SO2 10�棬SO3 45�棩
��װ��Iģ�ҵ������SO2�������ķ�Ӧ���仯ѧ����ʽ�� ��
�ڼ�ͬѧ������˳������װ�ã�װ��II����������װ�â�����Һ����ɫ������Mn2+ �� ��÷�Ӧ�����ӷ���ʽ�� ��
����ͬѧ������˳������װ�ã���װ��IV����40mL 2.5molL��1NaOH��Һ����Ӧ������4.8g����װ�â��з����ܷ�Ӧ�Ļ�ѧ����ʽ�� ��
���𰸡�
��1��H2SO3
��2��2SO2+O2![]() 2SO3��ʹSO3����ɹ�����SO2���룻5SO2+2H2O+2MnO4��=5SO42��+2Mn2++4H+��3SO2+4NaOH�TNa2SO3+2NaHSO3+H2O
2SO3��ʹSO3����ɹ�����SO2���룻5SO2+2H2O+2MnO4��=5SO42��+2Mn2++4H+��3SO2+4NaOH�TNa2SO3+2NaHSO3+H2O
����������1������صĺ�������������Ԫ�ػ��ϼ۷��飬���ݵ��������˳���ж�XΪ+4�۵���ΪH2SO3 ��
���Դ��ǣ�H2SO3 ����2���ٹ�ҵ������SO2�������ķ�Ӧ�Ƕ�������Ĵ�������Ӧ����ѧ����ʽΪ��2SO2+O2 ![]() 2SO3��
2SO3��
���Դ��ǣ�2SO2+O2 ![]() 2SO3��
2SO3��
��װ��II����������ȴװ�ã���������ķе�ϵͣ�ͨ����ˮ����ʹSO3����ɹ�����SO2���룬װ��III�и��������Һ��Ͷ�������Ӧ����ɫ������Mn2+��������������Ϊ���
��Ӧ�����ӷ���ʽΪ��5SO2+2H2O+2MnO4��=5SO42��+2Mn2++4H+��
���Դ��ǣ�ʹSO3����ɹ�����SO2���룬5SO2+2H2O+2MnO4��=5SO42��+2Mn2++4H+��
����װ��IV����40mL 2.5molL��1NaOH��Һ����Ӧ������4.8g�����յ�Ϊ�����������壬���ݶ����������ʵ����������������ʵ������з����ж����ɲ����n��SO2����n��NaOH��=1��2��Ӧ���շ�Ӧ��SO2+2NaOH=Na2SO3+H2O����n��SO2����n��NaOH��=1��1����Ӧ���շ�ӦSO2+NaOH=NaHSO3��װ��IV����40mL 2.5molL��1NaOH��Һ��n��NaOH��=0.1mol��n��SO2��= ![]() =0.075mol��n��SO2����n��NaOH��=0.075��0.1=3��4���������ɲ���Ϊ�������ƺ����������ƣ���Ӧ�Ļ�ѧ����ʽ����ֱƽ��д����3SO2+4NaOH�TNa2SO3+2NaHSO3+H2O��
=0.075mol��n��SO2����n��NaOH��=0.075��0.1=3��4���������ɲ���Ϊ�������ƺ����������ƣ���Ӧ�Ļ�ѧ����ʽ����ֱƽ��д����3SO2+4NaOH�TNa2SO3+2NaHSO3+H2O��
���Դ��ǣ�3SO2+4NaOH�TNa2SO3+2NaHSO3+H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�