题目内容
A、B、C是所学过的三种单质,A、B、C及其他物质之间的反应关系如图所示,其中B、D、E、F的水溶液呈酸性。若D+C E+F且常温下只有B为气态,则A、B、C分别为( )
E+F且常温下只有B为气态,则A、B、C分别为( )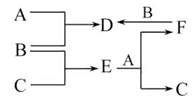
A.Fe、Cl2、Cu B.Fe、Cl2、H2 C.Cu、Cl2、Fe D.Fe、Cl2、Mg
A
解析

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
相关题目
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
| | 操作、现象 | 解释 |
| A | 向KI-淀粉溶液中加入FeCl3溶液,溶液变蓝 | Fe3+能与淀粉发生显色反应 |
| B | 把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点 | 铁在潮湿的空气中易生成Fe(OH)3 |
| C | 向稀硝酸中加入少量铁粉,有气泡产生 | 说明Fe置换出硝酸中的氢,生成了氢气 |
| D | 新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色 | 说明Fe(OH)2易被O2氧化成Fe(OH)3 |
两份等体积等浓度的NaOH溶液,分别与体积相等的AlCl3、MgCl2溶液混合,充分反应后Al3+、Mg2+均恰好完全沉淀,则原AlCl3、MgCl2溶液浓度之比是( )
| A.2∶3 | B.1∶2 | C.1∶1 | D.3∶2 |
无水氯化铝是一种重要的催化剂,工业上由Al2O3制备无水氯化铝的反应为:2Al2O3(s)+6Cl2(g) 4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
4AlCl3(g)+3O2(g) ΔH>0 。下列分析错误的是( )
| A.增大反应体系的压强,反应速率可能加快 |
| B.加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 |
| C.电解熔融的Al2O3和AlCl3溶液均能得到单质铝 |
| D.将AlCl3·6H2O在氯化氢气流中加热,也可制得无水氯化铝 |
Al、Fe、Cu都是重要的金属元素。下列说法正确的是( )
| A.三种金属单质在常温下均可溶于浓硫酸 |
| B.三种金属单质放置在空气中均只能生成氧化物 |
| C.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
| D.制备AlCl3、FeCl3、CuCl2三种固体物质,均不能采用将溶液直接蒸干的方法 |
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下: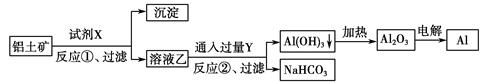
下列叙述正确的是( )。
| A.试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①、过滤后所得沉淀为氢氧化铁 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量可能为( )
| A.3.2 g | B.4.0 g | C.4.2 g | D.4.6 g |
类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能知道其正确与否。以下几种类推结论中正确的是( )
| A.金属镁失火不能用二氧化碳灭火器扑灭;金属钠失火也不能用二氧化碳灭火 |
| B.加热Ag2O可以得到单质银;加热CuO也可制取单质铜 |
| C.工业上用电解熔融MgCl2的方法制取金属镁;故也可用电解熔融AlCl3的方法制取金属铝 |
| D.Al和S直接化合可以得到Al2S3;Fe与S直接化合也可得到Fe2S3 |
