题目内容
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,下列叙述正确的是
| A.是指常温常压下,2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ |
| B.是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ |
| C.是指标准状况下,2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ |
| D.是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
B
该化学方程式指的是在标准状况下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出的热量是571.6 kJ,也即在标准状况下,2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ,答案选B

练习册系列答案
相关题目
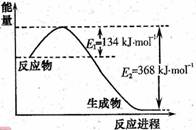
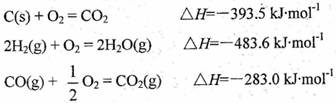
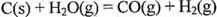 的焓变为 。
的焓变为 。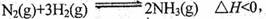 其化学平衡常数K与t的关系如下表:
其化学平衡常数K与t的关系如下表:
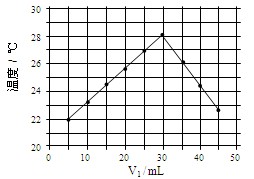
 ℃),盐酸和NaOH溶液的密度认为都是1
℃),盐酸和NaOH溶液的密度认为都是1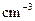 )
)