题目内容
【题目】根据所学知识,完成题目:
(1)Ⅰ含氮的化合物在化学反应中变化复杂.现用如图3所示仪器(夹持装置己省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O
②气体液化的温度:NO2 21℃、NO﹣152℃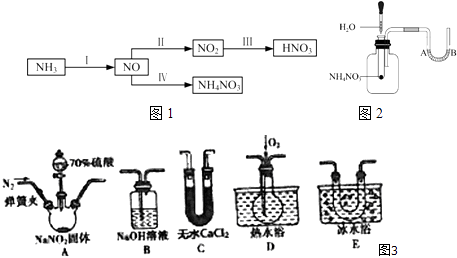
a.为了检验装置A中生成的气体产物,上述仪器的连接顺序(按左→右连接)为
b.反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
c.在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体.
①盛装70%浓硫酸的仪器名称是
②实验确认有NO的现象是
d.通过上述实验探究过程,可得出装置A中反应的化学方程式是 .
(2)Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3 , 如图1所示.【资料卡片】
①NH4NO3是一种白色晶体,易溶于水,微溶于乙醇.
②在230℃以上时,同时有弱光:2NH4NO3=2N2↑+O2↑+4H2O
③在400℃以上时,剧烈分解发生爆炸:4NH4NO3=3N2↑+2NO2↑+8H2O
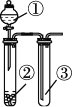
a.如图2将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因 .
b.实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是(填“能”或“不能”)用硝酸铵代替氯化铵.
c.在汽车发生碰撞时,NaN3会产生(填化学式)气体充满安全气囊来减轻碰撞事故中乘员伤害程度.
d.完成离子反应IV:NO+H2O=++H+ .
【答案】
(1)A→C→E→D→B;防止装置中的空气将NO氧化成NO2 , 影响产物的检验;分液漏斗;D中刚开始为无色,通入O2后变为红棕色;2NaNO2+H2SO4(浓)=Na2SO4+NO↑+NO2↑+H2O
(2)NH4NO3溶于水时吸收热量;2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;不能;N2;8;7;3NH4+;5NO3﹣;2
CaCl2+2NH3↑+2H2O;不能;N2;8;7;3NH4+;5NO3﹣;2
【解析】(1)a.解:A中产生的气体中含有NO、NO2、水蒸气,所以先通过C吸收水蒸气,然后在E中冷却二氧化氮得到NO2 , 在D装置中检验NO的存在,NO、NO2都是大气污染物,所以最后在装置B中进行尾气处理,防止污染空气,故装置的连接为A→C→E→D→B,所以答案是:A→C→E→D→B;b.NO很容易被氧气氧化,装置中有空气,无法检验有NO生成,所以通氮气的目的是排尽整个装置中的空气,防止产生的NO被氧化生成NO2 , 所以答案是:防止装置中的空气将NO氧化成NO2 , 影响产物的检验;c.①盛装70%浓硫酸的仪器名称是分液漏斗,所以答案是:分液漏斗;②实验确认有NO的现象是D中刚开始为无色,通入O2后变为红棕色,所以答案是:D中刚开始为无色,通入O2后变为红棕色;d.通过上述实验探究过程,可得出装置A中反应产生 NO、NO2、水和硫酸钠,该装置中的化学方程式是2NaNO2+H2SO4(浓)=Na2SO4+NO↑+NO2↑+H2O,所以答案是:2NaNO2+H2SO4(浓)=Na2SO4+NO↑+NO2↑+H2O;(2)a.将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因是NH4NO3溶于水时吸收热量,使广口瓶中的气体压强减小,在大气压强的作用下U形管中的液体左侧A液面上升,右侧B液面下降,所以答案是:NH4NO3溶于水时吸收热量;b.实验室可以用氯化铵和熟石灰反应来制备氨气,该反应的化学方程式是2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;由于硝酸铵具有强的氧化性,而且分解分解产生大量气体而发生爆炸,所以不能代替NH4Cl来实验,所以答案是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;由于硝酸铵具有强的氧化性,而且分解分解产生大量气体而发生爆炸,所以不能代替NH4Cl来实验,所以答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;不能;c.在汽车发生碰撞时,NaN3会产生N2气体充满安全气囊来减轻碰撞事故中乘员伤害程度,所以答案是:N2;d.根据电子守恒、电荷守恒和原子守恒,可知离子反应IV NO发生歧化反应产生NH4+和NO3﹣ , 同时产生水,反应的方程式是:8NO+7H2O=3NH4++5NO3﹣+2H+ , 所以答案是:8;7;3NH4+;5NO3﹣;2.
CaCl2+2NH3↑+2H2O;不能;c.在汽车发生碰撞时,NaN3会产生N2气体充满安全气囊来减轻碰撞事故中乘员伤害程度,所以答案是:N2;d.根据电子守恒、电荷守恒和原子守恒,可知离子反应IV NO发生歧化反应产生NH4+和NO3﹣ , 同时产生水,反应的方程式是:8NO+7H2O=3NH4++5NO3﹣+2H+ , 所以答案是:8;7;3NH4+;5NO3﹣;2.

【题目】利用如图所示装置进行下列实验,能达到实验目的的是 ( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓硫酸 | 铜 | 溴水 | 验证浓硫酸具有强氧化性 | |
B | 浓盐酸 | 浓硫酸 | 空气 | 制取并收集HCl | |
C | 浓氨水 | 氧化钙 | 空气 | 制取并收集NH3 | |
D | 稀硫酸 | Na2CO3 | Na2SiO3 溶液 | 验证酸性:硫酸>碳酸>硅酸 |
A. A B. B C. C D. D