题目内容
下列对分子或离子的立体构型判断不正确的是( )
| A、NH4+和CH4都是正四面体形 |
| B、CO2和CS2都是直线形 |
| C、NCl3和BCl3都是三角锥形 |
| D、H2O和H2S都是V形 |
考点:判断简单分子或离子的构型
专题:化学键与晶体结构
分析:根据价层电子对互斥理论确定其空间构型,价层电子对数=σ 键个数+孤电子对数,据此分析判断.
解答:
解:A、NH4+和CH4分子中的中心原子都是sp3杂化,无孤电子对数,空间构型都是正四面体形,故A正确;
B、CO2和CS2分子中的中心原子都是sp杂化,无孤电子对数,空间构型都是直线形,故B正确;
C、NCl3分子中的中心原子都是sp3杂化,有一对孤电子对,空间构型是三角锥型;BCl3分子中的中心原子都是sp2杂化,无孤电子对数,空间构型是平面三角形,故C错误;
D、H2O和H2S分子中的硫和氧元素位于同一主族,中心原子价层电子对数=σ 键个数+孤电子对数=2+2=4,中心原子都是sp3杂化,有两对孤电子,所以分子空间构型为V形,故D正确;
故选C.
B、CO2和CS2分子中的中心原子都是sp杂化,无孤电子对数,空间构型都是直线形,故B正确;
C、NCl3分子中的中心原子都是sp3杂化,有一对孤电子对,空间构型是三角锥型;BCl3分子中的中心原子都是sp2杂化,无孤电子对数,空间构型是平面三角形,故C错误;
D、H2O和H2S分子中的硫和氧元素位于同一主族,中心原子价层电子对数=σ 键个数+孤电子对数=2+2=4,中心原子都是sp3杂化,有两对孤电子,所以分子空间构型为V形,故D正确;
故选C.
点评:本题考查了判断分子或离子的空间构型,难度较大,注意孤电子对的存在分子的空间结构,为易错点.

练习册系列答案
相关题目
能用离子方程式“H++OH-═H2O”表示的化学反应是( )
| A、2NaOH+Si02═Na2Si03+H20 |
| B、HN03+KOH═KN03+H20 |
| C、S03+H20═H2S04 |
| D、2HCl+Na2C03═2NaCl+H20+C02↑ |
下列不属于取代反应的是( )
A、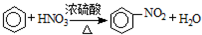 | ||
| B、CH2=CH2+Br2→BrCH2CH2Br | ||
C、CH4+Cl2
| ||
D、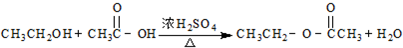 |
下面以橄榄岩(主要成分为硅酸镁,还有少量的Fe3+、Fe2+、Al3+及少量不溶于酸的杂质)为原料,制备硫酸镁晶体的流程图: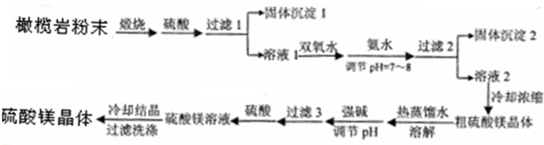
下列说法正确的是( )

下列说法正确的是( )
| A、过滤Ⅰ操作的主要目的是以硅酸盐的形式除去Si |
| B、加氨水调节pH═7-8,目的是使Fe3+、Al3+转化为氢氧化物沉淀而除去 |
| C、加双氧水时发生的主要反应为:H2O2+Fe2++2H+═Fe3++2H2O |
| D、粗硫酸镁晶体通过一系列操作后得到硫酸镁晶体,目的是使硫酸镁晶体结晶得更漂亮 |
对于化合物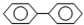 ,下列叙述中正确的是( )
,下列叙述中正确的是( )
 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A、其化学式为C12H12 |
| B、分子中所有原子有可能处于同一平面 |
| C、该化合物分子中所有原子不可能处于同一平面 |
| D、分子中所有原子一定处于同一平面 |
某元素的最高价含氧酸的阴离子符号是RO3-,则该元素的气态氢化物的化学式是( )
| A、HR |
| B、H2R |
| C、RH3 |
| D、不能确定 |
盛装下列溶液的试剂瓶采用的是玻璃塞的是( )
| A、Na2SiO3 |
| B、Na2CO3 |
| C、NH4Cl |
| D、HF |

 在如图所示的装置中进行中和反应的反应热测定,实验操作如下:
在如图所示的装置中进行中和反应的反应热测定,实验操作如下: