题目内容
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡 常数 | Ka=1.8×10-5 | 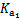 = =4.3×10-7 | 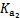 = =5.6×10-11 | Ka= 3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
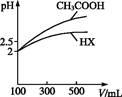
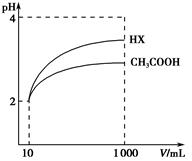
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。理由是 。
(4)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值),
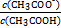 = 。
= 。
(1)adcb (2)BD (3)小于 稀释相同倍数,一元酸HX的pH变化比CH3COOH小,故酸性弱,电离平衡常数小 (4)9.9×10-7 18
解析

 阅读快车系列答案
阅读快车系列答案25 ℃时,有关物质的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.0×10-8 |
回答下列问题。
(1)物质的量浓度为0.1 mol·L-1的下列四种物质,pH由大到小的顺序是________(填编号)。
a.Na2CO3 b.NaClO
c.CH3COONa d.NaHCO3
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列各量一定变小的是________(填编号)。
A.c(H+) B.c(CH3COO-)
C.c(H+)·c(OH-) D.

(3)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是__________________;稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是_________________________________________________________________。
(4)25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________(填精确数值)。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: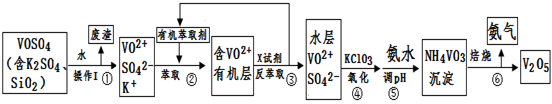
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
请回答有关滴定过程中的相关问题。
(1)用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,滴定曲线如图所示。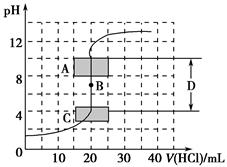
①在图中A的pH范围使用的指示剂是________;
C的pH范围使用的指示剂是________。
②下列关于上述中和滴定过程中的操作,正确的是________(填序号)。
| A.用碱式滴定管量取已知浓度的烧碱溶液 |
| B.滴定管和锥形瓶都必须用待装液润洗 |
| C.滴定过程中始终注视锥形瓶中溶液颜色变化 |
| D.锥形瓶中的待测液可用量筒量取 |
以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品。
已知:离子沉淀的pH见下表。
| 离子 | 开始沉淀pH | 沉淀完全pH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,写出其化学方程式 。
(2)步骤2中调节溶液pH的范围是 。
(3)取洗涤、干燥后的碱式碳酸锌68.2 g,充分灼烧后测得残留物质的质量为48.6 g,将所得气体通入足量澄清石灰水中,得沉淀20 g。计算碱式碳酸锌的组成(用化学式表示,写出计算过程)。
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: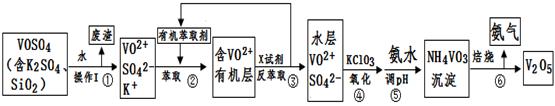
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
【已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39】
(5)该工艺流程中,可以循环利用的物质有 和 。
 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液: