题目内容
15.在14.2gNa2SO4中,含有Na+的数目是多少?含有SO4-的质量是多少?分析 根据n=$\frac{m}{M}$计算Na2SO4的物质的量,由化学式可知,钠离子物质的量为硫酸钠物质的量的2倍,硫酸根物质的量等于硫酸钠的物质的量计算.
解答 解:14.2g Na2SO4的物质的量为$\frac{14.2g}{142g/mol}$=0.1mol,
所含的Na+的物质的量是0.1mol×2=0.2mol,其数目为0.2NA,
所含SO42-的物质的量等于硫酸钠的物质的量是0.1mol,其质量为m=nM=0.1mol×96g/mol=9.6g;
答:含有Na+的数目是0.2NA;含有SO4-的质量是9.6g.
点评 本题考查物质的量有关计算,比较基础,注意根据化学式判断含有微粒与物质的物质的量关系.

练习册系列答案
相关题目
20.下列说法中,正确的是( )
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 金属与盐溶液反应都是置换反应 | |
| C. | 玻璃是氧化物,成分可表示成Na2O.CaO.6SiO2 | |
| D. | 与强酸、强碱都反应的物质只有两性氧化物和两性氢氧化物 |
7.分子数目为6.02×1022的CO2是( )
| A. | 1 mol | B. | 2.24 L | C. | 44 g/mol | D. | 4.4 g |
5. 已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如图所示,以下推断错误的是( )
 已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4↓+Al(OH)3↓ | |
| B. | C点对应的沉淀是:Fe(OH)3和BaSO4 | |
| C. | OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ | |
| D. | 据图计算原溶液中:c(Cl-)=c(SO42-) |
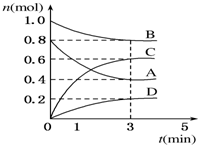 T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.
T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示. .
.