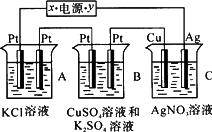
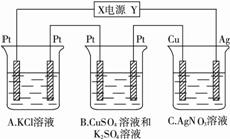
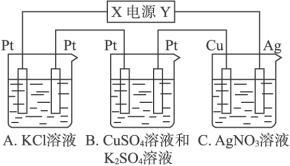
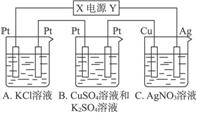
题目内容
如下图所示,若电解5 min,铜电极质量增加2.16 g。试回答:
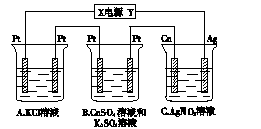
(1)电极X是电源的 极。
(2) pH变化:A ,B ,C 。
(3)若A中KCl溶液的体积为200 mL,电解至5 min,溶液的pH是 (假设溶液体积不变化)。
(1)负 (2)增大减小不变 (3) 13
解析:
(1)由铜电极质量增加可知铜电极为阴极,进一步可推知X是电源的负极。(2)A电解的方程式为2KCl+2H2O![]() H2↑+Cl2↑+2KOH,A溶液pH增大;B电解的方程式为2CuSO4+2H2O
H2↑+Cl2↑+2KOH,A溶液pH增大;B电解的方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,B溶液pH减小;C是电镀池,C溶液pH不变。(3)根据电子得失守恒得如下关系式:2KCl+2H2O
2Cu+O2↑+2H2SO4,B溶液pH减小;C是电镀池,C溶液pH不变。(3)根据电子得失守恒得如下关系式:2KCl+2H2O![]() H2↑+Cl2↑+2KOH~2e-~2Ag,由铜极上析出Ag的质量可计算出A中生成的KOH的物质的量,进而即可计算出A溶液的pH。
H2↑+Cl2↑+2KOH~2e-~2Ag,由铜极上析出Ag的质量可计算出A中生成的KOH的物质的量,进而即可计算出A溶液的pH。

练习册系列答案
相关题目