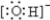题目内容
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(其它产物已略去)
试回答:
(1)若X是空气中存在的强氧化性无色气体单质,则A不可能是
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀.
①B与X反应的化学方程式为
②B溶液中阳离子的检验方法是
(3)若A、B、C均为含有金属元素的无机化合物,无论X是强酸还是强碱,A溶液与C溶液反应都能生成B,则反应的离子方程式为
(4)若A、B、C均为含有同种元素的共价化合物,且A的水溶液的pH>7,则A的水溶液的溶质的电离方程式为

试回答:
(1)若X是空气中存在的强氧化性无色气体单质,则A不可能是
de
de
(填“序号”).a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀.
①B与X反应的化学方程式为
2FeCl3+Fe═3FeCl2
2FeCl3+Fe═3FeCl2
.②B溶液中阳离子的检验方法是
取少量溶液于洁净的试管中,滴加硫氰化钾溶液,若溶液显红色,证明该阳离子存在
取少量溶液于洁净的试管中,滴加硫氰化钾溶液,若溶液显红色,证明该阳离子存在
.(3)若A、B、C均为含有金属元素的无机化合物,无论X是强酸还是强碱,A溶液与C溶液反应都能生成B,则反应的离子方程式为
3AlO2-+Al3++6H2O═4Al(OH)3↓
3AlO2-+Al3++6H2O═4Al(OH)3↓
.(4)若A、B、C均为含有同种元素的共价化合物,且A的水溶液的pH>7,则A的水溶液的溶质的电离方程式为
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
.分析:(1)若X是空气中存在的强氧化性无色气体单质,应为氧气,则A能连续与氧气反应,应为变价元素,如S、N等对应的单质,也可能为Na;
(2)若X是金属单质,应为Fe,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,证明含有氯离子,证明A气体是Cl2,
(3)若A、B、C均为含有金属元素的无机化合物,无论X是强酸还是强碱,A溶液与C溶液反应都能生成B,说明B为Al(OH)3,A、C可能为Al3++、AlO2-;
(4)A的水溶液的pH>7,且为共价化合物,应为NH3,则B为NO,C为NO2.
(2)若X是金属单质,应为Fe,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,证明含有氯离子,证明A气体是Cl2,
(3)若A、B、C均为含有金属元素的无机化合物,无论X是强酸还是强碱,A溶液与C溶液反应都能生成B,说明B为Al(OH)3,A、C可能为Al3++、AlO2-;
(4)A的水溶液的pH>7,且为共价化合物,应为NH3,则B为NO,C为NO2.
解答:解:(1)若X是空气中存在的强氧化性无色气体单质,应为氧气,则A能连续与氧气反应,应为变价元素,如S、N等对应的单质,也可能为Na,氧气和镁、铝反应生成的氧化物不能再和氧气反应,则de不可能,
故答案为:d e;
(2)若X是金属单质,应为Fe,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,证明含有氯离子,证明A气体是Cl2,
①B为氯化铁,与铁反应生成氯化亚铁,方程式为2FeCl3+Fe═3FeCl2,
答案为:2FeCl3+Fe═3FeCl2;
②B为氯化铁,检验铁离子可取少量溶液于洁净的试管中,滴加硫氰化钾溶液,若溶液显红色,证明该阳离子存在,
故答案为:取少量溶液于洁净的试管中,滴加硫氰化钾溶液,若溶液显红色,证明该阳离子存在;
(3)若A、B、C均为含有金属元素的无机化合物,无论X是强酸还是强碱,A溶液与C溶液反应都能生成B,说明B为Al(OH)3,A、C可能为Al3++、AlO2-,A溶液与C溶液反应都能生成B的离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O═4Al(OH)3↓;
(4)A的水溶液的pH>7,且为共价化合物,应为NH3,则B为NO,C为NO2,NH3?H2O为弱电解质,不能完全电离,电离方程式为NH3?H2O?NH4++OH-,
故答案为:NH3?H2O?NH4++OH-.
故答案为:d e;
(2)若X是金属单质,应为Fe,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,证明含有氯离子,证明A气体是Cl2,
①B为氯化铁,与铁反应生成氯化亚铁,方程式为2FeCl3+Fe═3FeCl2,
答案为:2FeCl3+Fe═3FeCl2;
②B为氯化铁,检验铁离子可取少量溶液于洁净的试管中,滴加硫氰化钾溶液,若溶液显红色,证明该阳离子存在,
故答案为:取少量溶液于洁净的试管中,滴加硫氰化钾溶液,若溶液显红色,证明该阳离子存在;
(3)若A、B、C均为含有金属元素的无机化合物,无论X是强酸还是强碱,A溶液与C溶液反应都能生成B,说明B为Al(OH)3,A、C可能为Al3++、AlO2-,A溶液与C溶液反应都能生成B的离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O═4Al(OH)3↓;
(4)A的水溶液的pH>7,且为共价化合物,应为NH3,则B为NO,C为NO2,NH3?H2O为弱电解质,不能完全电离,电离方程式为NH3?H2O?NH4++OH-,
故答案为:NH3?H2O?NH4++OH-.
点评:本题考查了物质转化关系的推断和应用,主要考查物质连续反应的特征,为考试高频考点,实现上述变化的物质很多,依据反应条件分析判断是解题关键.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
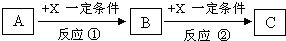
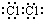

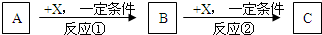

 现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.
现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.