题目内容
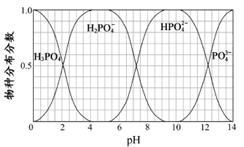
下图表示的是难溶氢氧化物在不同pH下的溶解度(S,mol/L),下列说法中正确的是( )
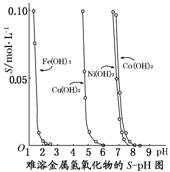
A.pH=3时溶液中铁元素的主要存在形式是Fe3+[来源:学。科。网]
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
【答案】
C
【解析】

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
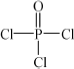 )与季戊四醇(
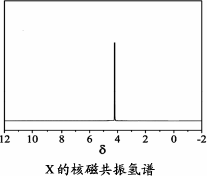
)与季戊四醇(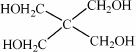 )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.
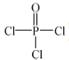 )与季戊四醇(
)与季戊四醇(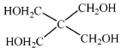 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
 )与季戊四醇(
)与季戊四醇(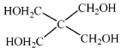 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
 60molCuSO4能氧化白磷的物质的量是 。
60molCuSO4能氧化白磷的物质的量是 。 )与季戊四醇(
)与季戊四醇(