题目内容
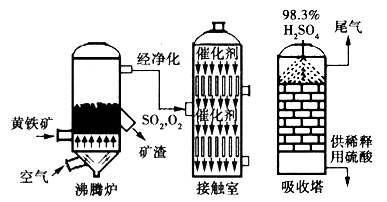
(15分)以黄铁矿为原料生产硫酸的工艺流程图如下:
![]()
(1)将燃烧黄铁矿的化学方程式补充完整
4 +11![]()
![]() (2)接触室中发生反应的化学方程式是 。
(2)接触室中发生反应的化学方程式是 。
![]() (3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
![]() a. 为使黄铁矿充分燃烧,需将其粉碎
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高![]() 的转化率
的转化率
c. 使用催化剂能提高![]() 的反应速率和转化率
的反应速率和转化率
d. 沸腾炉排出的矿渣可供炼铁
(4)每160g![]() 气体与
气体与![]() 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的![]() 和铵盐。
和铵盐。
①![]() 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的![]() 。
。![]() 吸收
吸收![]() 的离子方程式是 。
的离子方程式是 。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的![]() 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g。浓硫酸增加的质量为 。(计算结果保留两位小数)
(1)FeS2
(2)![]()
(3)a b d
(4)SO3(g) + H2O(l) = H2SO4(l);ΔH=-130.3kJ/mol
(5)①SO2 + Br2 + 2H2O = 4H+ + 2Br- + SO42-
②14.56 2.31g
解析:
本题主要考查硫酸工业、热化学方程式的书写、计算等。
(1)根据原子守恒即可判断该物质为FeS2。
(2)SO2和O2在接触室发生反应生成SO3:2SO2 + O2 ![]() 2SO3。
2SO3。
(3)选项a,将黄铁矿粉碎更增加反应接触面积而加快反应速率。选项b,增加空气(O2)浓度能提高SO2的转化率。选项c,催化剂对转化率无影响。选项d,矿渣中含有Fe2O3,可用于冶炼铁。
![]() (4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量,则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量,则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l);△H=-130.3kJ/mol。
(4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量,则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量,则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l);△H=-130.3kJ/mol。
![]() (5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L
(5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L
![]() 设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则
设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则
![]() 132X + 115y=10…………………………………………………….(1)
132X + 115y=10…………………………………………………….(1)
![]() 10g时说明铵盐不足由N守恒知
10g时说明铵盐不足由N守恒知
![]() n(NH3)=2X + y
n(NH3)=2X + y
20g时铵盐已经过量,氢氧化钠先和酸式根反应,则(NH4)2SO4为2Xmol,2ymol的NH4HSO4
HSO4― + OH― = SO42― + H2O1 1
2y 2y
NH4+ + OH― = NH3 + H2O
1 1
50C×10―3―2y 50C×10―3―2y
由于产生的氨气一样多
n(NH3)=2X + y=50C×10―3―2y………………………………….(2)
30g时铵盐过量,则(NH4)2SO4为3Xmol,3ymol的NH4HSO4 n(NH3)=0.68/17=0.04mol
HSO4― + OH― = SO42― +H2O
1 1
3y 3y
NH4+ + OH― = NH3 + H2O
1 1
50C×10―3―3y 0.04
所以
50C×10―3―3y=0.04…………………………………………………….(3)
联立(1) (2) (3)解得
X=0.02mol y=0.064mol C=4.64mol/L
氮的质量百分含量= ![]() ×100%=(0.04+0.064) ×14/10×100%=14.56%
×100%=(0.04+0.064) ×14/10×100%=14.56%
15g时铵盐已经过量,则(NH4)2SO4为1.5Xmol,1.5 ymol的NH4HSO4
HSO4― + OH― = SO42― + H2O
1 1
1.5y 1.5y
NH4+ + OH― = NH3 + H2O
1 1
50C×10―3―1.5y 50C×10―3―1.5y
n(NH3)= 50C×10―3―1.5y=50×4.64×10―3―1.5×0.064=0.136mol
m(NH3)=0.136×17=2.31g