题目内容
已知短周期元素的离子,a A2+、b B+、c C3+、d D-都具有相同的电子层结构,则下列叙述正确的是( )
| A、原子半径:A>B>D>C |
| B、原子序数:c>a>b>d |
| C、离子半径:C>D>B>A |
| D、单质的还原性:A>B>D>C |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:已知短周期元素的离子,aA2+、bB+、cC3+、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c-3=d+1,原子序数C>A>B>D,A、B、C处于同一周期,D处于上一周期,A、B、C形成阳离子,则A、B、C为金属,D形成阴离子,则D为非金属.结合元素周期律进行解答.
解答:
解:已知短周期元素的离子,aA2+、bB+、cC3+、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c-3=d+1,原子序数c>a>b>d,A、B、C处于同一周期,D处于上一周期,A、B、C形成阳离子,则A、B、C为金属,D形成阴离子,则D为非金属.
A、原子序数c>a>b>d,A、B、C处于同一周期,D处于上一周期,同周期,原子序数越大原子半径越小,所以原子半径B>A>C,电子层越多原子半径越大,所以原子半径B>A>C>D,故A错误;
B、aA2+、bB+、cC3+、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c-3=d+1,原子序数c>a>b>d,故B正确;
C、电子层结构相同,核电荷数越大,离子半径越小,核电荷数C>A>B>D,所以离子半径D->B+>A2+>C3+,故C错误;
D、A、B、C处于同一周期处于同一周期,A、B、C形成阳离子,则A、B、C为金属,原子序数C>A>B,单质还原性B>A>C,D形成阴离子,则D为非金属,单质的还原性:
B>A>C>D,故D错误.
故选B.
A、原子序数c>a>b>d,A、B、C处于同一周期,D处于上一周期,同周期,原子序数越大原子半径越小,所以原子半径B>A>C,电子层越多原子半径越大,所以原子半径B>A>C>D,故A错误;
B、aA2+、bB+、cC3+、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c-3=d+1,原子序数c>a>b>d,故B正确;
C、电子层结构相同,核电荷数越大,离子半径越小,核电荷数C>A>B>D,所以离子半径D->B+>A2+>C3+,故C错误;
D、A、B、C处于同一周期处于同一周期,A、B、C形成阳离子,则A、B、C为金属,原子序数C>A>B,单质还原性B>A>C,D形成阴离子,则D为非金属,单质的还原性:
B>A>C>D,故D错误.
故选B.
点评:本题考查位置结构性质的相互关系及应用,本题根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
下列图示的有关说法正确的是( )
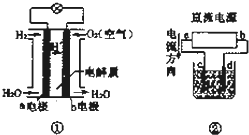

| A、装置①中负极反应式为H2+2e-═2H+ |
| B、装置①工作时,外电路电子由a电极流向b电极 |
| C、若采用装置②精炼铜,则d为粗铜,c为纯铜 |
| D、若装置②用惰性电极电解稀H2SO4溶液,则溶液pH升高 |
 可逆反应mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是( )
可逆反应mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T或压强P关系如图所示,下列叙述中正确的是( )| A、温度降低,化学平衡向正反应方向移动 |
| B、使用催化剂,D的物质的量分数增加 |
| C、化学方程式系数m+n=r+q |
| D、物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动 |
同一周期元素,其原子结构相同之处是( )
| A、最外层电子数相等 |
| B、核电荷数相等 |
| C、电子层数相等 |
| D、核外电子数相等 |
能较好说明乙醇分子结构简式为C2H5OH,而不是CH3OCH3的事实是( )
| A、1mol乙醇完全燃烧只生成2mol CO2和3mol H2O |
| B、乙醇无同分异构体 |
| C、0.1mol乙醇与足量钠反应只产生0.05mol氢气 |
| D、乙醇与水以任意比例互溶 |
乙酸分子的结构式为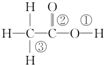 ,下列反应及断键部位正确的是( )
,下列反应及断键部位正确的是( )
(1)乙酸的电离,是①键断裂;
(2)乙酸与乙醇发生酯化反应,是②键断裂;
(3)在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2
CH2Br-COOH+HBr,是③键断裂;
(4)乙酸变成乙酸酐的反应:2CH3COOH→ +H2O,是①②键断裂.
+H2O,是①②键断裂.
 ,下列反应及断键部位正确的是( )
,下列反应及断键部位正确的是( )(1)乙酸的电离,是①键断裂;
(2)乙酸与乙醇发生酯化反应,是②键断裂;
(3)在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2
| 红磷 |
(4)乙酸变成乙酸酐的反应:2CH3COOH→
 +H2O,是①②键断裂.
+H2O,是①②键断裂.| A、(1)(2)(3) |
| B、(1)(2)(3)(4) |
| C、(2)(3)(4) |
| D、(1)(3)(4) |

