题目内容
阿伏加德罗常数为NA,下列叙述中不正确的是 ( )
①12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA
②0.5 mol·L—1 Mg(NO3)2溶液中含有为2NA
③7.8 g Na2S和Na2O2的固体混合物中含有的阴离子数大于0.1NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
⑤足量Fe与0.1 mol氯气反应时失去的电子数为0.3 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦agC2H4和C3H6的混合物所含共用电子对数目为3aNA/14
①12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA
②0.5 mol·L—1 Mg(NO3)2溶液中含有为2NA
③7.8 g Na2S和Na2O2的固体混合物中含有的阴离子数大于0.1NA
④2mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
⑤足量Fe与0.1 mol氯气反应时失去的电子数为0.3 NA
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA
⑦agC2H4和C3H6的混合物所含共用电子对数目为3aNA/14
| A.①④⑦ | B.①③④⑤⑥ | C.②③⑤⑥ | D.③④⑤⑥ |
C
试题分析:①、石墨烯中每个碳原子被3个六元环公用,故每个六元环实际占有2个碳原子,12克石墨烯含有1摩碳原子,即石墨烯中含有的六元环的个数为0.5 NA,正确; ②未指明溶液的体积,无法计算NO
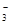 的数目,错误;③Na2S和Na2O2的摩尔质量都是78g/mol,都含有一个阴离子,7.8 g的固体混合物中含有的阴离子数等于0.1NA,错误;④ SO2和 O2为可逆反应,正确;⑤足量Fe与0.1 mol氯气反应时失去的电子数为0.2 NA,错误;⑥稀硫酸与铜不反应,生成SO2的分子数小于0.1 NA,错误; ⑦agC2H4和C3H6的混合物所含共用电子对数目为3aNA/14,正确;故C正确;
的数目,错误;③Na2S和Na2O2的摩尔质量都是78g/mol,都含有一个阴离子,7.8 g的固体混合物中含有的阴离子数等于0.1NA,错误;④ SO2和 O2为可逆反应,正确;⑤足量Fe与0.1 mol氯气反应时失去的电子数为0.2 NA,错误;⑥稀硫酸与铜不反应,生成SO2的分子数小于0.1 NA,错误; ⑦agC2H4和C3H6的混合物所含共用电子对数目为3aNA/14,正确;故C正确;
练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目