题目内容
向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3)。请回答下列问题:
(1)若x的平均值为1.3,则磁流体中Fe2+和Fe3+的质量之比为 。
(2)若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式:
将该反应设计为原电池,负极电极反应为 ,当消耗1L 1.1mol/L KI溶液时,外电路通过电子数刚好为NA个,则该电池的化学能转化为电能的转化效率为 。
(3)为测定该磁流体中Fe2+的含量,取化学式为K1.5FeO2的样品2g溶解在稀硫酸中并稀释到100ml,取出2mL加入10ml 0.005mol/L的KMnO4(在酸性条件下KMnO4被Fe2+还原为Mn2+),充分反应后再加入150ml 0.001mol/L的FeSO4,溶液紫红色恰好完全褪色,则原样品中Fe2+的质量分数为 。溶解样品若选择稀硝酸测定结果 (填偏高,偏低,无影响)
(1)若x的平均值为1.3,则磁流体中Fe2+和Fe3+的质量之比为 。
(2)若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式:
将该反应设计为原电池,负极电极反应为 ,当消耗1L 1.1mol/L KI溶液时,外电路通过电子数刚好为NA个,则该电池的化学能转化为电能的转化效率为 。
(3)为测定该磁流体中Fe2+的含量,取化学式为K1.5FeO2的样品2g溶解在稀硫酸中并稀释到100ml,取出2mL加入10ml 0.005mol/L的KMnO4(在酸性条件下KMnO4被Fe2+还原为Mn2+),充分反应后再加入150ml 0.001mol/L的FeSO4,溶液紫红色恰好完全褪色,则原样品中Fe2+的质量分数为 。溶解样品若选择稀硝酸测定结果 (填偏高,偏低,无影响)
(1)3:7 ;
(2)10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+ 10K2SO4+20H2O ;2I—-2e-= I2 ; 90.9%;
(3)14% 偏低
(2)10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+ 10K2SO4+20H2O ;2I—-2e-= I2 ; 90.9%;
(3)14% 偏低
试题分析:(1)当
 = 1.3时,即KxFeO2为K1.3FeO2,其最简整数比的化学式为K13Fe10O20即
= 1.3时,即KxFeO2为K1.3FeO2,其最简整数比的化学式为K13Fe10O20即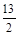 K2O·3FeO·
K2O·3FeO· Fe2O3,则n(Fe2+): n(Fe3+)=3:7,故m(Fe2+): m(Fe3+)=3:7。
Fe2O3,则n(Fe2+): n(Fe3+)=3:7,故m(Fe2+): m(Fe3+)=3:7。(2)当
 = 1.4时,即K1.4FeO2,当其在稀硫酸条件下与足量的KI溶液反应时,其反应实质是Fe3+和I-在酸性条件下发生氧化还原反应生成Fe2+和I2,K1.4FeO2的化学组成可看作7K2O·4FeO·3Fe2O3,故其化学反应方程式为:10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+ 10K2SO4+20H2O;将该反应设计为原电池,则负极失电子发生氧化反应,故其电极反应式为:2I—-2e-= I2;由氧化还原反应可知,理论上每消耗1mol KI转移1mol电子即1NA个,而实际上消耗了1L 1.1mol/L KI溶液即消耗n(KI)= 1L×1.1mol/L=1.1mol,故该电池的化学能转化为电能的转化效率为1÷1.1×100%=90.9%。
= 1.4时,即K1.4FeO2,当其在稀硫酸条件下与足量的KI溶液反应时,其反应实质是Fe3+和I-在酸性条件下发生氧化还原反应生成Fe2+和I2,K1.4FeO2的化学组成可看作7K2O·4FeO·3Fe2O3,故其化学反应方程式为:10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+ 10K2SO4+20H2O;将该反应设计为原电池,则负极失电子发生氧化反应,故其电极反应式为:2I—-2e-= I2;由氧化还原反应可知,理论上每消耗1mol KI转移1mol电子即1NA个,而实际上消耗了1L 1.1mol/L KI溶液即消耗n(KI)= 1L×1.1mol/L=1.1mol,故该电池的化学能转化为电能的转化效率为1÷1.1×100%=90.9%。(3)根据氧化还原反应得失电子守恒知,KMnO4~5Fe2+(KMnO4→Mn2+得到5e-,Fe2+→Fe3+失去e-),依题意得与磁流体反应的n(KMnO4) = 10×10-3L×0.005mol/L-
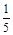 ×150×10-3L×0.001mol/L=0.02×10-3 mol,则取样(
×150×10-3L×0.001mol/L=0.02×10-3 mol,则取样(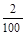 ×2g K1.5FeO2)中与KMnO4反应的n(Fe2+)=5×0.02×10-3 mol=0.1×10-3 mol,即m(Fe2+)=56g/mol×0.1×10-3 mol=5.6×10-3 g,故原样品中Fe2+的质量分数为5.6×10-3 g÷0.04g×100%=14%;若溶解样品时选择稀硝酸(具强氧化性)则会导致部分Fe2+被氧化成Fe3+,致使最终测得的Fe2+的质量分数偏低。
×2g K1.5FeO2)中与KMnO4反应的n(Fe2+)=5×0.02×10-3 mol=0.1×10-3 mol,即m(Fe2+)=56g/mol×0.1×10-3 mol=5.6×10-3 g,故原样品中Fe2+的质量分数为5.6×10-3 g÷0.04g×100%=14%;若溶解样品时选择稀硝酸(具强氧化性)则会导致部分Fe2+被氧化成Fe3+,致使最终测得的Fe2+的质量分数偏低。
练习册系列答案
相关题目
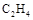 混合气体体积约为22.4L,质量为28g
混合气体体积约为22.4L,质量为28g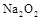 固体与H2O完全反应转移的电子数为NA
固体与H2O完全反应转移的电子数为NA


