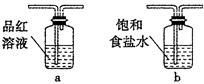
题目内容
根据要求完成下列实验。(a、b 为弹簧夹,其他装置略去)
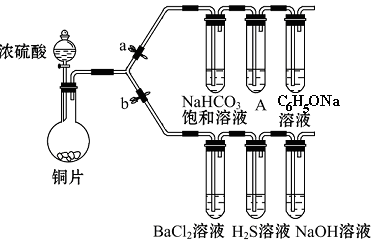
(一)验证酸性的相对强弱:碳酸>苯酚。(已知酸性:亚硫酸 >碳酸)
(1)铜与浓硫酸反应的化学方程式是_________________________________________,
装置A中的足量的试剂是 。
(2)连接仪器、 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。能说明碳酸的酸性比苯酚酸性强的实验现象是:____________________________。
(二)验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a。能验证SO2具有氧化性的化学方程式是_______________________。
(4)若过量的SO2通入NaOH溶液中,其化学方程式是:____________________________。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式分别是__________________,_________________。
(6)写出其中SO2显示还原性并生成白色沉淀的总的离子方程式___________________________________________________________。

(一)验证酸性的相对强弱:碳酸>苯酚。(已知酸性:亚硫酸 >碳酸)
(1)铜与浓硫酸反应的化学方程式是_________________________________________,
装置A中的足量的试剂是 。
(2)连接仪器、 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。能说明碳酸的酸性比苯酚酸性强的实验现象是:____________________________。
(二)验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a。能验证SO2具有氧化性的化学方程式是_______________________。
(4)若过量的SO2通入NaOH溶液中,其化学方程式是:____________________________。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式分别是__________________,_________________。
(6)写出其中SO2显示还原性并生成白色沉淀的总的离子方程式___________________________________________________________。
(1) (2分)
(2分)
酸性高锰酸钾溶液或品红溶液(1分 合理给分)
(2)检验装置的气密性(1分)A中的酸性高锰酸钾溶液(或品红溶液)不褪色,苯酚钠溶液变浑浊。(1分)
(3)2H2S+SO2→3S↓+2H2O(2分)
(4)SO2+NaOH→NaHCO3(1分)
(5)BaSO3,BaSO4(2分)
(6)Ba2++SO2+Cl2+2H2O→BaSO4↓+4H++2Cl-(2分)
 (2分)
(2分) 酸性高锰酸钾溶液或品红溶液(1分 合理给分)
(2)检验装置的气密性(1分)A中的酸性高锰酸钾溶液(或品红溶液)不褪色,苯酚钠溶液变浑浊。(1分)
(3)2H2S+SO2→3S↓+2H2O(2分)
(4)SO2+NaOH→NaHCO3(1分)
(5)BaSO3,BaSO4(2分)
(6)Ba2++SO2+Cl2+2H2O→BaSO4↓+4H++2Cl-(2分)
试题分析:(1)铜与浓硫酸反应的化学方程式是
 ,装置A的作用是除去二氧化硫,防止干扰二氧化硫与苯酚钠的反应,可以利用强氧化性物质如:装置A中的足量的试剂是酸性高锰酸钾溶液或品红溶液。
,装置A的作用是除去二氧化硫,防止干扰二氧化硫与苯酚钠的反应,可以利用强氧化性物质如:装置A中的足量的试剂是酸性高锰酸钾溶液或品红溶液。(2)装置A中反应制备气体,在加入药品之前需要检验装置的气密性。利用强酸制备弱酸,A中KMnO4溶液没有完全褪色,盛有苯酚钠溶液的试管中出现白色沉淀即可说明。
(3)要验证SO2具有氧化性化合价要降低,则发生2H2S+SO2=3S↓+2H2O这个反应。
(4)若过量的SO2通入NaOH溶液中,酸过量生成酸式盐,其化学方程式是:SO2+NaOH=NaHCO3。
(5)应后的BaCl2溶液中含有亚硫酸,亚硫酸被氯水氧化物硫酸,硫酸与氯化钡反应生成硫酸钡,亚硫酸与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成硫酸钡,故都产生白色沉淀,故答案为:两份溶液中均有白色沉淀生成;
(6)二氧化硫被氯水氧化为硫酸,反应中二氧化硫表现还原性,同时与氯化钡反应生成硫酸钡沉淀,故反应离子方程式为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-,故答案为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目

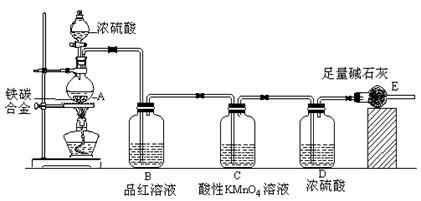
 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。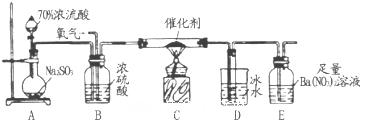
 CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。
CO2↑+2SO2↑+2H2O,其中浓H2 S04所起的作用是 (填“氧化剂”或“还原剂”)。若有0.2mol碳的完全反应,则消耗H2S04的质量是 g,标况下产生SO2的体积为______________L。