题目内容
向混有Fe2O3的铁屑中加入足量的稀硫酸直到固体物质完全溶解,如果得到的溶液中不含Fe3+,且产生的Fe2+与H2的物质的量之比为3∶1,则原混合物中Fe2O3与Fe的物质的量之比为( )A.1∶1 B.2∶5
C.4∶1 D.3∶1
B
解析:本题涉及的反应及先后顺序如下:
①Fe2O3+6H+![]() 2Fe3++3H2O
2Fe3++3H2O
②2Fe3++Fe![]() 3Fe2+
3Fe2+
③Fe+2H+![]() Fe2++H2↑
Fe2++H2↑
设氢气的物质的量为1 mol,则Fe2+的物质的量为3 mol,其中有2 mol 来自反应②、1 mol 来自反应③。
因此,n(Fe2O3)=
n(Fe)=n(H2)+![]() n(Fe2+)=
n(Fe2+)=![]() mol
mol

练习册系列答案
相关题目
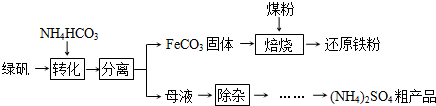
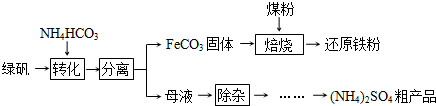
绿矾(FeSO4?7H2O)的一种综合利用工艺如下:
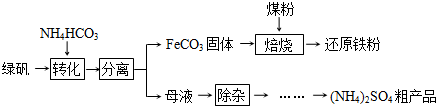
(1)绿矾与NH4HCO3在溶液中按物质的量之比1:2反应,有CO2生成,反应的离子方程式为______.
(2)隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3 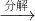 FeO
FeO  Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式______.
Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式______.
(3)“除杂”步骤为:向母液中通入含臭氧的空气、调节pH、过滤,除去的杂质离子是______.
(4)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、______.浓缩时若温度过高,产品中将混有NH4HSO4,运用化学平衡移动原理解释其原因______.
(5)绿矾的另一种综合利用方法是:绿矾脱水后在有氧条件下焙烧,FeSO4转化为Fe2O3和硫的氧化物.分析下表实验数据,为了提高SO3的含量,可采取的措施是______.
| 空气通入量/L?s-1 | 温度/℃ | SO2含量/% | SO3含量/% |
| 0.02 | 850 | 45.4 | 54.6 |
| 0.06 | 850 | 30.5 | 69.5 |
| 0.10 | 850 | 11.1 | 88.9 |
| 0.10 | 810 | 11.1 | 88.9 |
| 0.10 | 890 | 11.2 | 88.8 |