题目内容
(2012?广州一模)绿矾(FeSO4?7H2O)的一种综合利用工艺如下:
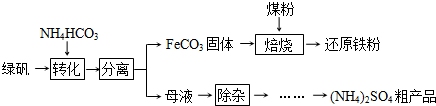
(1)绿矾与NH4HCO3在溶液中按物质的量之比1:2反应,有CO2生成,反应的离子方程式为
(2)隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3
FeO
Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式
(3)“除杂”步骤为:向母液中通入含臭氧的空气、调节pH、过滤,除去的杂质离子是
(4)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、
(5)绿矾的另一种综合利用方法是:绿矾脱水后在有氧条件下焙烧,FeSO4转化为Fe2O3和硫的氧化物.分析下表实验数据,为了提高SO3的含量,可采取的措施是

(1)绿矾与NH4HCO3在溶液中按物质的量之比1:2反应,有CO2生成,反应的离子方程式为
Fe2++2HCO3-=CO2↑+FeCO3↓+H2O
Fe2++2HCO3-=CO2↑+FeCO3↓+H2O
.(2)隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3
| 分解 |
| 还原 |
FeCO3
FeO+CO2↑;C+CO2
2CO;CO+FeO
Fe+CO2
| ||
| ||
| ||
FeCO3
FeO+CO2↑;C+CO2
2CO;CO+FeO
Fe+CO2
.
| ||
| ||
| ||
(3)“除杂”步骤为:向母液中通入含臭氧的空气、调节pH、过滤,除去的杂质离子是
Fe2+
Fe2+
.(4)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、
过滤
过滤
.浓缩时若温度过高,产品中将混有NH4HSO4,运用化学平衡移动原理解释其原因NH4++H2O?NH3?H2O+H+,温度过高一水合氨分解氨气挥发,平衡正向进行,酸性增强生成硫酸氢铵
NH4++H2O?NH3?H2O+H+,温度过高一水合氨分解氨气挥发,平衡正向进行,酸性增强生成硫酸氢铵
.(5)绿矾的另一种综合利用方法是:绿矾脱水后在有氧条件下焙烧,FeSO4转化为Fe2O3和硫的氧化物.分析下表实验数据,为了提高SO3的含量,可采取的措施是
增大空气通入量
增大空气通入量
.| 空气通入量/L?s-1 | 温度/℃ | SO2含量/% | SO3含量/% |
| 0.02 | 850 | 45.4 | 54.6 |
| 0.06 | 850 | 30.5 | 69.5 |
| 0.10 | 850 | 11.1 | 88.9 |
| 0.10 | 810 | 11.1 | 88.9 |
| 0.10 | 890 | 11.2 | 88.8 |
分析:(1)依据流程图分析,绿矾加入碳酸氢铵得到碳酸亚铁,同时生成二氧化碳,结合碳酸亚铁溶解性小于氢氧化亚铁,离子方程式遵循原子守恒、电荷守恒写出;
(2)铁元素的转化途径是FeCO3
FeO
Fe,还原剂是加入的煤生成的一氧化碳,转化关系中碳酸亚铁隔绝空气受热分解生成氧化亚铁和 二氧化碳,二氧化碳和碳反应生成还原剂一氧化碳;一氧化碳还原氧化亚铁为金属铁;
(3)绿矾溶解和碳酸氢铵反应后的滤液中含有亚铁离子;
(4)依据母液“除杂”后,欲得到(NH4)2SO4粗产品可知结晶析出的晶体需要通过过滤方法得到固体,铵根离子水解是吸热反应,升高温度平衡向铵根离子水解方向进行,温度较高氨气放出促进平衡正向进行,溶液酸性增强;
(5)依据图表数据分析,温度变化对三氧化硫含量影响不大,通入空气增多增大二氧化硫转化率,三氧化硫含量增大.
(2)铁元素的转化途径是FeCO3
| 分解 |
| 还原 |
(3)绿矾溶解和碳酸氢铵反应后的滤液中含有亚铁离子;
(4)依据母液“除杂”后,欲得到(NH4)2SO4粗产品可知结晶析出的晶体需要通过过滤方法得到固体,铵根离子水解是吸热反应,升高温度平衡向铵根离子水解方向进行,温度较高氨气放出促进平衡正向进行,溶液酸性增强;
(5)依据图表数据分析,温度变化对三氧化硫含量影响不大,通入空气增多增大二氧化硫转化率,三氧化硫含量增大.
解答:解:(1)流程图分析,绿矾与NH4HCO3在溶液中按物质的量之比1:2反应,有CO2生成,绿矾加入碳酸氢铵得到碳酸亚铁,同时生成二氧化碳,依据原子守恒电荷守恒写出离子方程式为:
Fe2++2HCO3-=CO2↑+FeCO3↓+H2O,
故答案为:Fe2++2HCO3-=CO2↑+FeCO3↓+H2O;
(2)铁元素的转化途径是FeCO3
FeO
Fe,还原剂是加入的煤生成的一氧化碳,转化关系中碳酸亚铁隔绝空气受热分解生成氧化亚铁和 二氧化碳,二氧化碳和碳反应生成还原剂一氧化碳;一氧化碳还原氧化亚铁为金属铁;反应的化学方程式为:FeCO3
FeO+CO2↑、C+CO2
2CO、CO+FeO
Fe+CO2,
故答案为:FeCO3
FeO+CO2↑、C+CO2
2CO、CO+FeO
Fe+CO2;
(3)绿矾溶解和碳酸氢铵反应后的滤液中含有亚铁离子;向母液中通入含臭氧的空气氧化亚铁离子为铁离子、调节pH铁离子全部沉淀、过滤,除去的杂质离子是Fe2+,
故答案为:Fe2+;
(4)母液“除杂”后,得到(NH4)2SO4粗产品,可知结晶析出的晶体需要通过过滤方法得到固体,铵根离子水解是吸热反应,升高温度平衡向吸热反应方向进行,即向铵根离子水解方向进行,温度较高氨气放出促进平衡正向进行,溶液酸性增强生成硫酸氢铵,
故答案为:过滤;NH4++H2O?NH3?H2O+H+,温度过高一水合氨分解氨气挥发,平衡正向进行,酸性增强生成硫酸氢铵;
(5)依据图表数据分析改变温度对三氧化硫的量影响不大,改变空气的量会提高二氧化硫的转化率得到三氧化硫增多,故答案为:增大空气通入量.
Fe2++2HCO3-=CO2↑+FeCO3↓+H2O,
故答案为:Fe2++2HCO3-=CO2↑+FeCO3↓+H2O;
(2)铁元素的转化途径是FeCO3
| 分解 |
| 还原 |
| ||
| ||
| ||
故答案为:FeCO3
| ||
| ||
| ||
(3)绿矾溶解和碳酸氢铵反应后的滤液中含有亚铁离子;向母液中通入含臭氧的空气氧化亚铁离子为铁离子、调节pH铁离子全部沉淀、过滤,除去的杂质离子是Fe2+,
故答案为:Fe2+;
(4)母液“除杂”后,得到(NH4)2SO4粗产品,可知结晶析出的晶体需要通过过滤方法得到固体,铵根离子水解是吸热反应,升高温度平衡向吸热反应方向进行,即向铵根离子水解方向进行,温度较高氨气放出促进平衡正向进行,溶液酸性增强生成硫酸氢铵,
故答案为:过滤;NH4++H2O?NH3?H2O+H+,温度过高一水合氨分解氨气挥发,平衡正向进行,酸性增强生成硫酸氢铵;
(5)依据图表数据分析改变温度对三氧化硫的量影响不大,改变空气的量会提高二氧化硫的转化率得到三氧化硫增多,故答案为:增大空气通入量.
点评:本题考查了物质制备的流程分析判断,铁元素及其化合物性质的应用,分离混合物的实验操作和方法应用,平衡影响因素的分析判断,题目难度中等.

练习册系列答案
相关题目
 (2012?广州一模)某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )
(2012?广州一模)某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )