题目内容
 在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,
在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,18NO(g)+2C3H6(g)?9N2(g)+6CO2 (g)+6H2O(g)+Q1 …①
18NO2(g)+4C3H6(g)?9N2(g)+12CO2(g)+12H2O(g)+Q2 …②
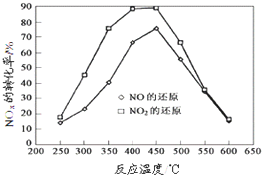
将NO与丙烯的混合气体充入恒容密闭容器中,在有催化剂存在时,在不同温度下反应,测得NO转化率与反应温度的关系曲线,并在相同条件下测得NO2转化率与反应温度的关系曲线(见图).
(1)反应①、②的平衡常数分别为K1和K2,写出平衡常数表达式:K1=
(2)要使反应②速率加快,并提高NO2的转化率,可以采取的措施是
(3)从如图得出的结论正确的是
a.Q1>0 b.550℃时K1=K2
c.催化剂在450~500℃时活性最大
(4)根据如图分析,在用丙烯还原NO的反应体系中加入适量的O2,将会使NO的转化率
分析:(1)依据平衡常数概念列式写出,生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
(2)依据影响化学反应速率的因素分析判断,两种反应物,增加一种物质的量会提高另一种物质的转化率,增大浓度提高反应速率;
(3)a、图象分析氮氧化物转化率随温度变化显增大,后减小,说明反应达到平衡后升温平衡逆向进行,依据平衡移动原理分析判断反应吸热、放热;
b、550°C只能说明一氧化氮和二氧化氮转化率相同,但不同反应平衡常数不同;
c、催化剂活性最大是指氮氧化物转化率最大时的温度;
(4)一氧化氮和氧气反应生成二氧化氮.
(2)依据影响化学反应速率的因素分析判断,两种反应物,增加一种物质的量会提高另一种物质的转化率,增大浓度提高反应速率;
(3)a、图象分析氮氧化物转化率随温度变化显增大,后减小,说明反应达到平衡后升温平衡逆向进行,依据平衡移动原理分析判断反应吸热、放热;
b、550°C只能说明一氧化氮和二氧化氮转化率相同,但不同反应平衡常数不同;
c、催化剂活性最大是指氮氧化物转化率最大时的温度;
(4)一氧化氮和氧气反应生成二氧化氮.
解答:解:(1)依据化学平衡18NO(g)+2C3H6(g)?9N2(g)+6CO2 (g)+6H2O(g),反应达到平衡的平衡常数表达式为:K=
,
故答案为:
;
(2)要使反应②速率加快,并提高NO2的转化率,可以增大丙烷的浓度,增大反应速率,提高二氧化氮的转化率,故答案为:增加丙烯的浓度;
(3)a、图象分析氮氧化物转化率随温度变化显增大,后减小,说明反应达到平衡后升温平衡逆向进行,逆向是吸热反应,正向是放热反应,所以Q1>0,故a正确;
b、550℃只能说明一氧化氮和二氧化氮转化率相同,但不同反应平衡常数不同,故b错误;
c、催化剂活性最大是指氮氧化物转化率最大时的温度,依据图象分析得到;催化剂在450~500℃时活性最大,加快反应速率,但平衡不动,转化率不变,故c错误;
故选a;
(4)在用丙烯还原NO的反应体系中加入适量的O2,氧气和一氧化氮反应生成二氧化氮,一氧化氮气体转化率增大,故答案为:提高.
| c9(N2)×c6(CO2)×c6(H2O) |
| c18(NO)c2(C3H6) |
故答案为:
| c9(N2)×c6(CO2)×c6(H2O) |
| c18(NO)c2(C3H6) |
(2)要使反应②速率加快,并提高NO2的转化率,可以增大丙烷的浓度,增大反应速率,提高二氧化氮的转化率,故答案为:增加丙烯的浓度;
(3)a、图象分析氮氧化物转化率随温度变化显增大,后减小,说明反应达到平衡后升温平衡逆向进行,逆向是吸热反应,正向是放热反应,所以Q1>0,故a正确;
b、550℃只能说明一氧化氮和二氧化氮转化率相同,但不同反应平衡常数不同,故b错误;
c、催化剂活性最大是指氮氧化物转化率最大时的温度,依据图象分析得到;催化剂在450~500℃时活性最大,加快反应速率,但平衡不动,转化率不变,故c错误;
故选a;
(4)在用丙烯还原NO的反应体系中加入适量的O2,氧气和一氧化氮反应生成二氧化氮,一氧化氮气体转化率增大,故答案为:提高.
点评:本题考查了化学平衡常数的计算应用,图象分析能力,化学平衡影响因素的分析判断,转化率的变化分析是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 .有机物X的键线式为
.有机物X的键线式为  .下列说法不 正确的是( )
.下列说法不 正确的是( )



 和
和

