题目内容
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现将氢气和氮气充入某密闭容器中,在一定条件下反应的有关数据为:
项目 | H2 | N2 | NH3 |
起始时 | 5 mol·L-1 | 3 mol·L-1 | 0 |
2 s末 | 2 mol·L-1 |
|
|
(1)氢气和氮气反应生成氨气(在2 s内)的反应速率v(H2)=__________。若此时已达平衡,则可求得平衡常数为__________。
(2)下图表示合成NH3反应在时间t0→t6中反应速率与反应过程曲线图,则在下列达到化学平衡的时间段中,化学平衡常数最大的一段时间是__________。
①t0→t1 ②t2→t3 ③t3→t4 ④t5→t6
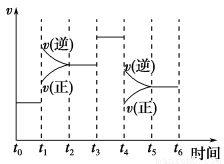
若t1时改变的条件是升高温度,则说明合成NH3反应的焓变ΔH________0(填“大于”或“小于”)。
(1)1.5 mol·L-1·s-1 0.25 (2)① 小于
【解析】(1)根据合成氨反应3H2(g)+N2(g) 2NH3(g)和表中数据,计算得v(H2)=1.5 mol·L-1·s-1,达到平衡时各物质的浓度分别为n(H2)=2 mol·L-1,n(N2)=2 mol·L-1,n(NH3)=2 mol·L-1,即可求出平衡常数为0.25。
2NH3(g)和表中数据,计算得v(H2)=1.5 mol·L-1·s-1,达到平衡时各物质的浓度分别为n(H2)=2 mol·L-1,n(N2)=2 mol·L-1,n(NH3)=2 mol·L-1,即可求出平衡常数为0.25。
(2)由图可知,从t1开始是化学反应速率增大,而逆反应速率大于正反应速率,说明平衡向左移动,化学平衡常数减小;从t3开始是反应速率增大,平衡不移动,平衡常数相等;从t4开始是化学反应速率减少,而逆反应速率减小的少,大于正反应速率,平衡向左移动,平衡常数减小,故化学平衡常数最大的一段是t0~t1。
升高温度,平衡向左移动,故正向是放热反应ΔH<0。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目