题目内容
【题目】铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
(1)实验中发生反应的化学方程式是___________________________。
(2)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ ______________。过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_________(填“偏高”、“偏低”或“无影响”)。
[方案二]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01![]() 105Pa)的体积。
105Pa)的体积。
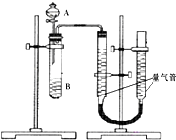
〖问题讨论〗(3)同学们拟选用图一实验装置完成实验:

①你认为最简易的装置其连接顺序是:A接(____)(_____)接(____)( )接( )(填接口字母,可不填满。)②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因_________________________。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的是__________。(有几个选几个)。
A.等待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
(4)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了图二的实验装置。

①装置中导管a的作用是_________________________。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。(用含V1、V2的式子表达)
【答案】 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 97mL 偏高 E D G 镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大 ACD 使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差 V1-V2
【解析】方案一:⑴.铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
⑵.含镁为3%时,金属铝的含量最高,5.4g合金中铝的质量为5.4g×(13%)=5.4×97% g,则:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
54g 2mol
5.4g×97% g V×103L×2.0mol/L
得54g:(5.4g×97% g)=2mol:(V×103L×2.0mol/L),解得V=97,NaOH溶液的体积97mL;镁上会附着偏铝酸钠等物质,若未洗涤固体,会导致测定镁的质量偏大,镁的质量分数偏高;
故答案为:97mL;偏高;
方案二:⑶.①.合金与稀硫酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)、(D)接(G);
故答案为:E、D、G;
②.镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大,导致硫酸不能顺利滴入锥形瓶;故答案为:镁、铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;
③.反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积;
故答案选ACD;
⑷.①.装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差,故答案为:使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②.滴定管的0刻度在上方,两次读取的体积数值之差为测定的氢气的体积,收集氢气后滴定管内液面上升,读数减小,所以测定氢气的体积为V1V2,故答案为:V1V2。

【题目】下列关于化学电源的说法正确的是( )
A. 干电池放电之后还能再充电
B. 充电电池在放电和充电时都将化学能转化为电能
C. 充电电池可以无限制地反复放电、充电
D. 氢氧燃料电池是一种环境友好型电池
【题目】甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O) 甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)
序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究对化学反应速率的影响.
(2)分液漏斗中A溶液应该加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是 . 乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X= A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是 .